-
氢氧化铁胶体稳定存在的主要原因是
A. 胶粒直径小于1 nm B. 胶粒不停地作无规则运动
C. 胶粒带正电荷 D. 胶粒不能通过半透膜
难度: 简单查看答案及解析
-
对于下列事实的解释错误的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落
难度: 简单查看答案及解析
-
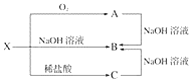
在氯化铁、氯化铜混合溶液中加入铁粉和铜粉,充分反应后仍有固体存在,则下列判断正确的是( )
A.加入硫氰化钾溶液可能变红色 B.溶液中一定含有Fe2+
C.溶液中一定不含Cu2+ D.剩余固体中一定含有铁
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.同温同压下,相同体积的物质,其物质的量必然相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必然相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.同温同压下,等体积的物质所含的分子数一定相等
难度: 中等查看答案及解析
-
用氢氧化钠固体配制1 mol·L-1氢氧化钠溶液,下列仪器中一定要用到的是
①托盘天平 ②量筒 ③容量瓶 ④试管 ⑤烧杯 ⑥玻璃棒 ⑦酒精灯 ⑧胶头滴管
A.①③⑤⑥⑦ B.②③⑤⑥⑧ C.①③⑤⑥⑧ D.②③④⑤⑧
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.自然界中存在大量的单质硅
B.石英、水晶、硅石的主要成分都是二氧化硅
C.二氧化硅的化学性质活泼,能跟酸或碱的溶液发生化学反应
D.自然界中硅元素都存在于石英中
难度: 简单查看答案及解析
-
北京2008年奥运会金牌的直径为70 mm,厚度为6 mm。奖牌正面为插上翅膀站立的希腊胜利女神和希腊潘纳辛纳科竞技场,奖牌背面镶嵌着取自中国古代龙纹玉璧造型的玉璧,环形玉璧由白玉制成,白玉的环形成分可简单看作是Ca2Mg5Si8O22(OH)2,将其改写成氧化物的形式为
A.5CaO·2MgO·8SiO2·H2O B.2CaO·5MgO·8SiO2·2H2O
C.2CaO·5MgO·8SiO2·H2O D.2CaO·8MgO·5SiO2·H2O
难度: 简单查看答案及解析
-
以NA代表阿伏加德罗常数,下列说法正确的是
A.常温常压32g O2含2NA个原子
B.标准状况下11.2L H2O含有的原子数目为1.5NA
C.1mol的Cl-含有NA个电子
D.0.5mol/L的NaCl溶液中Cl-的个数为0.5NA
难度: 简单查看答案及解析
-
下列有关合金的叙述中正确的是( )
A.合金的密度比各成分金属小
B.合金的抗腐蚀性能都很好
C.合金的导电性比各成分金属强
D.合金的种类和性能与成分有关
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.分离氯化钠和氯化银的混合物,可用蒸馏法
B.从碳酸钠溶液中得到碳酸钠,可用过滤法
C.分离酒精与四氯化碳的混合物,可用蒸馏法
D.从碘的四氯化碳溶液中得到四氯化碳,可用萃取法
难度: 中等查看答案及解析
-
将等质量的下列物质分别投入等质量的足量水中,所得溶液质量分数最大的是( )
A.金属钠
B.氧化钠
C.过氧化钠
D.氢氧化钠
难度: 简单查看答案及解析
-
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门等。下列性质与这些用途无关的是( )
A. 强度高 B. 不易生锈 C. 密度小 D. 导电、导热性好
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.64 g氧气中含氧分子数为2NA
B.1.7 g 氢氧根离子中所含的电子数为NA
C.49 g硫酸中所含氧原子数为2NA
D.58.5 g氯化钠中所含的离子数为NA
难度: 简单查看答案及解析
-
标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 简单查看答案及解析
-
用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成氧化铜,氧化铜再与硝酸反应。下列叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量是:途径③>途径①>途径②
D.所消耗硝酸的物质的量是:途径①>途径②>途径③
难度: 中等查看答案及解析
-
下列各组物质,按化合物、单质、混合物的顺序排列的是( )
A.烧碱、液态氧、碘酒 B.干冰、铁、冰水混合物
C.生石灰、白磷、熟石灰 D.碱石灰、氮气、胆矾
难度: 简单查看答案及解析
-
当光束通过下列分散系时,可能产生丁达尔效应的是( )
A.NaCl溶液 B.蒸馏水 C.盐酸 D.稀豆浆
难度: 简单查看答案及解析
-
将
g Na和
g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为
下列说法正确的是
A.反应中放出的气体在标准状况下的体积为
B.参加反应的水的质量与加入Al的质量相等
C.所得溶液中
和
的物质的量之比为2:1
D.所得溶液中阳离子和阴离子的物质的量之比为1:1
难度: 中等查看答案及解析
-
下列各组中两溶液间的反应,不能用同一离子方程式来表示的是( )
A.Na2CO3+HCl;K2CO3+HNO3 B.Fe+HCl;Fe+H2SO4
C.BaCl2+Na2SO4;Ba(OH)2+H2SO4 D.NaOH+H2SO4;Ba(OH)2+HCl
难度: 简单查看答案及解析
-
将4.6 g钠放入95.6 g水中,所得溶液的质量分数是( )
A.4.6% B.7.7% C.8% D.10%
难度: 简单查看答案及解析
-
下列关于金属单质的叙述不正确的是( )
A.常温下金属都是银白色的固体
B.金属都具有良好的传热性和导电性
C.大多数金属都具有延展性
D.金属具有较高的熔点,但差异较大
难度: 简单查看答案及解析
-
某原子的摩尔质量是 M g /mol,则一个该原子的实际质量是( )
A.Mg B.
C.
D.
难度: 中等查看答案及解析
-
下列各组溶液间的反应,可用同一个离子方程式表示的是
A.盐酸与碳酸钠,盐酸与碳酸钙
B.氯化钡与硫酸钠,氢氧化钡与硫酸镁
C.氢氧化钠与盐酸,氢氧化钠与醋酸
D.硝酸钙与碳酸钠,氯化钙与碳酸钾
难度: 简单查看答案及解析
-
除去镁粉中的少量铝粉,可选用( )
A.硫酸 B.水 C.盐酸 D.氢氧化钠溶液
难度: 简单查看答案及解析
-
向Ba(OH)2溶液中逐滴加入稀硫酸,溶液导电性的变化合理的图像为
A.
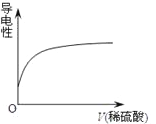 B.
B.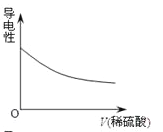 C.
C.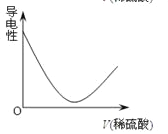 D.
D.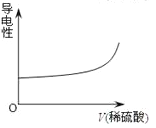
难度: 简单查看答案及解析
-
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I﹣>Fe2+>NO B.I﹣>Fe2+>H2SO3>NO
C.Fe2+>I﹣>H2SO3>NO D.NO>Fe2+>H2SO3>I﹣
难度: 简单查看答案及解析
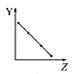 b.
b. 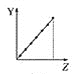 d.
d.