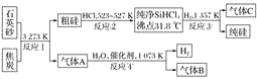
-
Cu2S是火法炼铜的重要原料之一,如图是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图。
Cu2S
Cu
Cu2O、CuO
A
B
胆矾
(1)Cu2S中铜元素的化合价为___,火法炼铜的反应原理是__________(用化学方程式表示)。
(2)向Cu2O、CuO中加入足量稀硫酸得到的体系A中溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式____________。
(3)若将A中红色物质反应掉,操作Ⅰ中加入的试剂最好是___(填字母序号)。
A.适量的NaNO3
B.适量的HNO3
C.适量的H2O2
(4)若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH由2变为1(体积变化忽略不计),此时电解过程中转移电子的物质的量是_____。
(5)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示。通过计算确定258℃时发生反应的化学方程式:____,e点对应物质的化学式为_____(计算过程略去)。
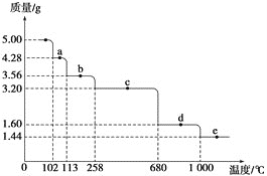
难度: 中等查看答案及解析
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
难度: 困难查看答案及解析
-
某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
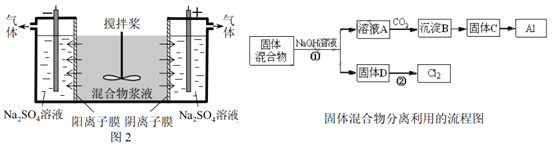
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
难度: 困难查看答案及解析
-
(题文)8−羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8−羟基喹啉的合成路线。
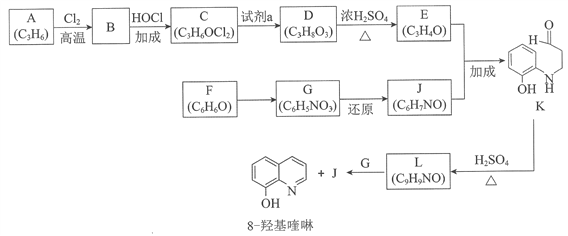
已知:i.
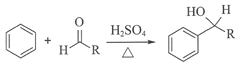
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________

(8)合成8−羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
难度: 中等查看答案及解析
-
[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4
GeBr4
GeI4
熔点/℃
−49.5
26
146
沸点/℃
83.1
186
约400
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
,0,
);C为(
,
,0)。则D原子的坐标参数为_______________。
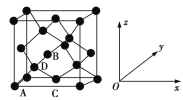
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm−3(列出计算式即可)。
难度: 中等查看答案及解析