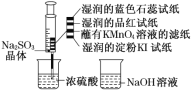
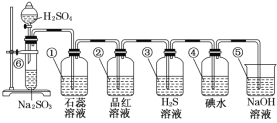
-
下列关于SO2的说法中,不正确的是( )
A. SO2是硫及某些含硫化合物在空气中燃烧的产物
B. SO2具有漂白性,可以使品红溶液褪色
C. SO2溶于水后生成H2SO4
D. SO2是一种大气污染物
难度: 简单查看答案及解析
-
下列物质中,不能用做漂白剂的是
A.SO2 B.Ca(ClO)2 C.NaClO D.H2SO4(浓)
难度: 简单查看答案及解析
-
下列酸在与金属发生反应时,其中S或N元素的化合价不会发生变化的是
A.浓硝酸 B.浓硫酸 C.稀硝酸 D.稀硫酸
难度: 简单查看答案及解析
-
有关下列三个反应的叙述,正确的是( )
①2H2S+SO2=3S↓+2H2O
②S+2H2SO4(浓)
3SO2↑+2H2O
③3S+6KOH
2K2S+K2SO3+3H2O
A.反应①说明SO2能与酸反应,具有碱性氧化物的性质
B.反应②改用稀H2SO4,则能放出氢气
C.反应②和③说明S具有两性元素的性质
D.反应③说明S既具有氧化性又具有还原性
难度: 简单查看答案及解析
-
下列试剂能用于鉴别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③④⑤ B.③④
C.①②③⑤ D.②③④⑤
难度: 简单查看答案及解析
-
浓硫酸和2 mol·L−1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如图。分析a、b曲线变化的原因是
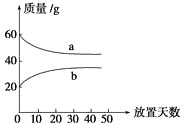
A.a升华、b冷凝 B.a挥发、b吸水 C.a蒸发、b潮解 D.a冷凝、b吸水
难度: 中等查看答案及解析