-
在以离子键为主的化学键中常含有共价键的成分.下列各对原子形成化学键中共价键成分最少的是( )
A. Na,F B. Al,O C. Li,Cl D. Mg,S
难度: 中等查看答案及解析
-
12月1日为世界艾滋病日。医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是
A.14C原子与C60中普通碳原子的化学性质不同
B.14C原子与14N原子所含中子数相同
C.是C60的同素异形体
D.与12C、13C是碳元素的三种同位素
难度: 简单查看答案及解析
-
下列各表中的数字代表的时原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
对下列化学用语的理解正确的是( )
A.比例模型
 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子B.电子式
既可以表示羟基,也可以表示氢氧根离子
C.乙烷的最简式可表示为CH3
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
难度: 简单查看答案及解析
-
化学与社会、生活密切相关。下列有关说法错误的是
A.明矾中铝离子水解产生的胶体具有很强的吸附作用而常用于净水
B.地球上99%以上的溴蕴藏在大海中,因此溴被称为“海洋元素”
C.目前加碘盐中添加的含碘物质是KI,可用氯水和淀粉溶液鉴定食盐是否加碘
D.为减少污染、提高燃烧效率,可将煤气化或液化获得清洁燃料
难度: 简单查看答案及解析
-
下列叙述中,错误的是( )
A.烷烃的取代反应和烯烃的加成反应均能生成卤代烃
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷
D.苯分子的六个碳碳键完全相同,六个碳氢键不相同,能发生加成反应和取代反应
难度: 简单查看答案及解析
-
下列推理正确的是( )
A.铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O
B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂
难度: 中等查看答案及解析
-
下列实验操作及现象与结论对应关系正确的一组是
实验操作
实验现象
实验结论
A
适量二氧化碳通入氯化钡溶液中
产生沉淀
碳酸的酸性比盐酸弱
B
二氧化硫通入溴水中
溶液褪色
二氧化硫有漂白性
C
取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置
溶液分层,下层呈橙红色
原无色溶液中一定有溴离子
D
将铜片放入浓硝酸中
产生大量无色气体,
溶液呈蓝绿色只体现浓硝酸的强氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是
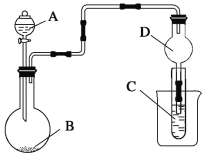
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断,其中错误的是( )
①硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
②铊(T既能与盐酸作用产生氢气,又有跟Na0H溶液反应放出氢气
③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸
④锂在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤硫酸锶(SrSO4)是难溶于水的白色固体
A.①②③④ B.①②④ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
短周期元素W、U、Q、R的原子序数依次增大,W元素的一种原子无中子,U与R同主族、与Q同周期,Q是地壳中含量最多的非金属元素,R元素原子的最外层电子数是内层电子数的0.4倍,下列有叙述正确的是( )
A.UQ2与RQ2的化学键类型和分子结构相同
B.RQ2为酸性氧化物,可以与强碱反应,但不能与任何酸反应
C.UW4与UQ2均为只含极性键的非极性分子
D.常温下R的单质很稳定,既不与酸反应,也不与强碱反应
难度: 中等查看答案及解析
-
现有三种有机物甲、乙、丙,其结构如图所示:

下列有关说法中错误的是
A.甲、乙、丙都是芳香族化合物,只有两种能与碳酸氢钠溶液反应
B.只用碳酸氢钠溶液和银氨溶液能检验甲、乙、丙
C.与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3∶4∶3
D.甲的化学式为C11H14O2,乙含有两种含氧官能团
难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )

A.将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体
B.相对于途径①③,途径②更好地体现了绿色化学思想
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.Y可能是葡萄糖
难度: 中等查看答案及解析
-
11.6 gFe3O4加到100 mL某浓度的盐酸中,再加入9.8 g铁粉,反应停止时,溶液中无固体存在。向溶液中滴加硫氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化成Fe(OH)2,共消耗5.0 mol·L-1NaOH溶液160mL。则原盐酸的物质的量浓度为( )
A. 2 mol·L-1 B. 4 mol·L-1 C. 6 mol·L-1 D. 8 mol·L-1
难度: 困难查看答案及解析
-
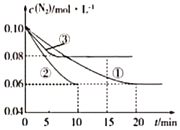
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A.该反应的化学方程式为5A+4B
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
难度: 中等查看答案及解析
-
工业上利用可逆反应N2(g)+3H2(g)
2NH3(g)合成氨,下列叙述正确的是
A. 合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率
B. 恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=(c2-c1)/(t2-t1)
难度: 中等查看答案及解析