-
我国“蛟龙号多次刷新“中国深度”,为我国深海矿物资源的开发奠定了坚实的基础。黄铜矿(主要成分为CuReS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在7000米的深海中承受710吨的重量。下列说法正确的是___。
A.金属钛属于主族元素
B.钛合金强度不是很大
C.制备钛铝合金时可在空气中将两种金属熔化后混合而成
D.已知金属钛能与H2O反应,可用电解熔融二氧化钛冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为8CuReS2+21O2 8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___。(填元素符号),生成1molFe2O3时转移电子的物质的量为___。
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___。(填元素符号),生成1molFe2O3时转移电子的物质的量为___。
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为①用过量稀盐酸浸取炉渣,过滤。②先将滤液氰化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煆烧得Fe2O3。据以上信息回答下列问题:
a.①中过滤的目的是___,过滤需要的仪器有___。
b.除去A13+的化学方程式为___。
c.②中将滤液氧化常常选用H2O2,其反应的离子方程式为___。
(4)将Cu放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为___。
-
Ⅰ.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如图:
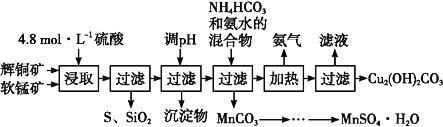
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有________________(任写一种)。
(2)调节浸出液pH的范围为________,其目的是 ____________________。
(3)本工艺中可循环使用的物质是________(写化学式)。
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成__________的结果。
Ⅱ.海水开发利用的部分过程如下图所示。
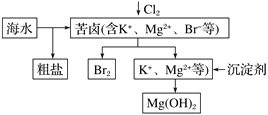
(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过______、________、_________的操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______________。
-
辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
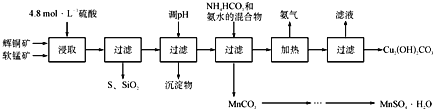
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe 3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
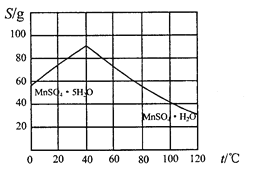
(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
-
《厉害了,我的国》展示了中国五年来探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是
A.为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属一次能源
B.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
-
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是
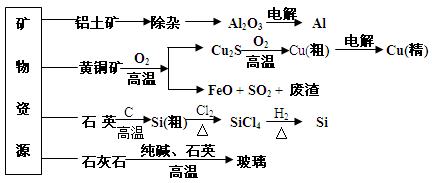
A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
-
从含铜丰富的自然资源黄铜矿(主要成分为CuFeS2)中冶炼铜的工艺流程如下:
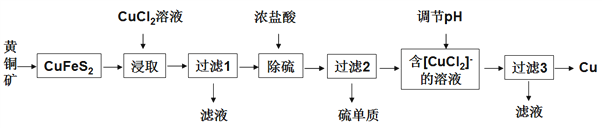
已知:  。
。
(1)若“过滤1”所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为______。
(2)“除硫”时加入浓盐酸发生反应的离子方程式为_____________________________。
(3)“过滤3”所得滤液中可以循环使用的物质为______________、_____________。
(4)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,发生的反应为 、
、 。此工艺与前一工艺相比主要缺点有______________________(任答一点)。
。此工艺与前一工艺相比主要缺点有______________________(任答一点)。
(5)铜溶解于H2O2和H2SO4的混合溶液中可制备CuSO4。测定溶液中Cu2+浓度的方法:准确量取V1 mL溶液于锥形瓶中,调节pH至3~4,加入过量KI溶液,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L的Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。上述过程中发生的反应为 、
、 。
。
①“恰好完全反应”时溶液的颜色变化为___________________。
②溶液中Cu2+的物质的量浓度为________________________(用含c、V1、V2的代数式表示)mol/L。
-
为了充分利用铜资源,某工厂拟用黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如图:
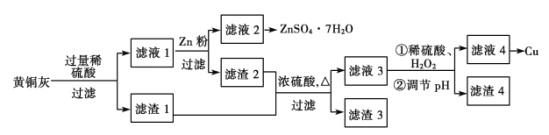
(1)滤渣1的主要成分为__。稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的反应的离子方程式是__。
(2)滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是__(填化学式),实验室通常用__(填化学式)溶液吸收。
(3)从滤液2中获取硫酸锌晶体的方法是加热浓缩、__、过滤等。
(4)过滤操作所需玻璃仪器除玻璃棒外还有__。
(5)根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__。
-
稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
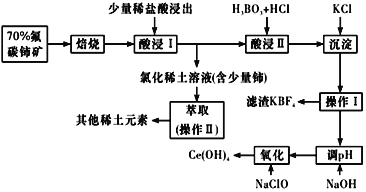
已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是 ___________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是_______。
(3)向Ce(BF4)3中加入KCl溶液的目的是_________。
(4)操作I的名称为_________,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于______即可认为Ce3+已完全沉淀。{已知:Ksp[Ce(OH)3]=1.0 ×10-20}
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为______(保留2位小数,已知氧化性:Ce4+ >KMnO4;Ce(OH)4 的相对分子质量为208)
-
我国研制的第二代“彩虹鱼”万米级深海着陆器所用金属材料主要是钛合金。以钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)为主要原料制钛的流程如下:
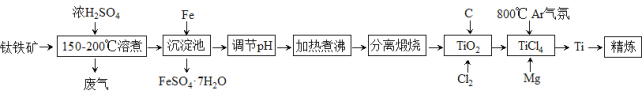
已知:① 钛在常温下不与强酸、强碱反应;② Ti4+易水解生成TiO2+, TiO2+进一步水解可得H2TiO3。
(1) “废气”中含有少量空气污染物,其分子式为________。
(2) “150-200℃溶煮”时生成Ti(SO4)2和TiOSO4且有气体产生,写出生成TiOSO4反应的化学方程式___________________________________。
(3) 沉淀池中加入Fe时,开始无气泡,溶液由棕黄色变浅绿色,片刻后有无色无味气体产生。写出Fe参与的离子反应方程式____________________________。
(4) “加热煮沸”操作的主要目的是_____________。
(5) “精炼” 阶段,从Ti、Mg混合物获得Ti时可以使用的试剂是_______________。
-
开发和利用矿物资源有重要的意义。某厂用无机矿物资源生产部分材料,其产品流程示意图如下,下列有关说法不正确的是( )
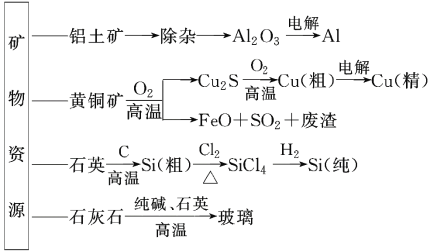
A. 制取粗硅时生成的气体产物为CO
B. 生产铝、铜、高纯硅及玻璃的过程中都涉及氧化还原反应
C. 黄铜矿冶炼铜时,产生的SO2可用于生产硫酸,产生的FeO可用作冶炼铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___。(填元素符号),生成1molFe2O3时转移电子的物质的量为___。









