-
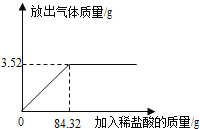
Fe2O3和铁粉的混合物中加入适量稀H2SO4,各物质恰好完全反应,测得溶液中不含Fe3+,且Fe2+与H2物质的量之比为4:1,那么在反应中Fe2O3、Fe、H2SO4的物质的量之比为( )
A.1:1:1 B.1:2:3 C.1:2:4 D.2:3:5
难度: 中等查看答案及解析
-
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A.1∶1 B.2∶1 C.1∶2 D.2∶3
难度: 简单查看答案及解析
-
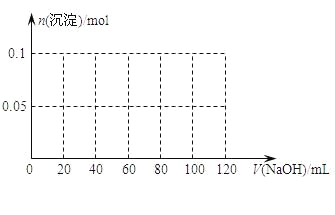
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A. 60mL B. 45mL C. 30mL D. 15mL
难度: 中等查看答案及解析
-
20mL浓度为0.05mol·L-1的含Mn+离子的溶液,恰好把15mL的浓度为0.1mol·L-1的含S2-溶液中的S2-离子全部沉淀,则n的值是 ( )
A.4 B.3 C.2 D.1
难度: 中等查看答案及解析
-
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02g B.8.26g C.8.51g D.7.04g
难度: 中等查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。
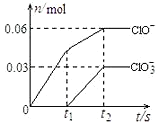
下列说法正确的是 ( )
A.苛性钾溶液中KOH的质量是4.94g
B.ClO-的生成是由于温度升高引起的
C.氧化性ClO-<ClO3-
D.反应中转移电子的物质的量是0.21mol
难度: 中等查看答案及解析