-
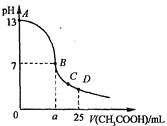
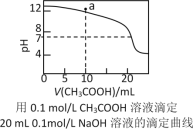
某碱性溶液中只含有Na+、CH3COO-、H+、OH-4种离子。下列描述正确的是( )。
A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+)
难度: 困难查看答案及解析
-
常温下,向0.1 mol·L-1的CH3COONa溶液中逐滴滴加等浓度的HCl溶液,则下列关系正确的是
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.c(Na+)=c(CH3COOH)+c(CH3COO-)
D.c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
难度: 中等查看答案及解析
-
H2SO3是二元弱酸,NaHSO3溶液呈酸性,在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是
A.

B.

C.
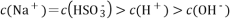
D.

难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③
B.将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4)
C.0.1mol·L-1K2HPO4和0.2mol/L KH2PO4的混合溶液:c(K+)+c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH-)
D.0.1mol·L-1CH3COONa与0.15mol·L-1HCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
难度: 中等查看答案及解析
-
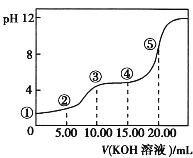
常温下,用 0.1 mol·L-1HCl溶液滴定10.0 mL浓度为0.1 mol·L-1 Na2CO3溶液,所得滴定曲线如如图所示。下列说法正确的是
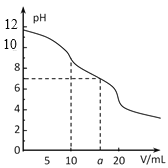
A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-)
B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)
D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
A.在0.1mol·L-1Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.向0.1mol·L-1盐酸与0.1mol·L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)
D.向0.1mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
难度: 中等查看答案及解析
-
常温下,下列各溶液的叙述中正确的是
A.NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D.向1.00L0.3mol·L-1NaOH溶液中缓慢通入0.2molCO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数
(25℃)Ka=1.77×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11下列选项正确的是
A.2CN-+H2O+CO2=2HCN+CO32-
B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D.c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
难度: 中等查看答案及解析