-
下列各组微粒中,在一定条件下均可以作氧化剂的是( )
A. Fe、H2O、CO2 B. Fe3+、MnO4—、NO3—
C. Cl2、HClO、Mg D. ClO-、Cl-、Ag+
难度: 中等查看答案及解析
-
能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应:OH-+H+=H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑
难度: 简单查看答案及解析
-
已知Co2O3在酸性溶液中易被还原成Co2+,而Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.Cl2+FeI2=FeCl2+I2 B.3Cl2+6FeI2=2FeCl3+4FeI3
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3++2I-=2Fe2++I2
难度: 中等查看答案及解析
-
能用H++OH-=H2O来表示的化学反应是
A.氢氧化镁和稀盐酸反应 B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应 D.二氧化碳通入澄清石灰水中
难度: 简单查看答案及解析
-
FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中错误的是
A.Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7 m(注意nm与m的换算)
B.分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C.三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性
D.三种分散系均属于混合物
难度: 简单查看答案及解析
-
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
分类
名称(俗名)
化学式
A
碱性氧化物
氧化铁
FeO
B
酸性氧化物
碳酸气
CO
C
酸
硫酸
H2SO3
D
盐
纯碱
Na2CO3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下面关于电解质的叙述中错误的是( )
A.在水溶液中和熔融状态下均不导电的化合物叫非电解质
B.电解质、非电解质都指化合物而言,单质不属于此范畴
C.电解质在水中一定能导电,在水中导电的化合物一定是电解质
D.纯水的导电性很差,但水也是电解质
难度: 简单查看答案及解析
-
已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-,②ClO3-+5Cl-+6H+=3Cl2+3H2O,
③2FeCl3+2KI=2FeCl2+2KCl+I2,④2FeCl2+Cl2=2FeCl3。下列各微粒氧化能力由强到弱的顺序正确的是
A.ClO3->BrO3->Cl2>Fe3+>I2 B.BrO3->Cl2>ClO3->I2>Fe3+
C.BrO3->ClO3->Cl2>Fe3+>I2 D.BrO3->ClO3->Fe3+>Cl2>I2
难度: 简单查看答案及解析
-
下列反应中不是氧化还原反应的是
A. 3Cl2+6KOH===5KCl+KClO3+3H2O
B. CuO+H2
Cu+H2O
C. 2KMnO4
K2MnO4+MnO2+O2↑
D. 2AgNO3+BaCl2===2AgCl↓+Ba(NO3)2
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.硝酸银与盐酸反应:AgNO3+Cl-===AgCl↓+NO
B.铜片插入硝酸银溶液中:Cu+Ag+===Ag+Cu2+
C.硫酸和氯化钡溶液反应:Ba2++SO
===BaSO4↓
D.铁钉放入硫酸铜溶液中:2Fe+3Cu2+===2Fe3++3Cu
难度: 简单查看答案及解析
-
常温下,发生下列几种反应:①16H++10Z-+2XO4—=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-根据上述反应,判断下列结论错误的是( )
A.溶液中可发生:Z2+2A2+=2A3++2Z-
B.Z2在①③反应中为还原剂
C.氧化性强弱的顺序为:XO4—>Z2>B2>A3+
D.X2+是XO4—的还原产物
难度: 简单查看答案及解析
-
向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,如图中的曲线可近似表示整个过程中混合溶液的导电能力变化的是(用电流强度I表示)
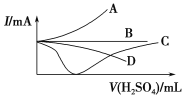
A. 曲线A B. 曲线B C. 曲线C D. 曲线D
难度: 中等查看答案及解析
-
随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后Na2SO3转化为
A.Na2SO4 B.SO2 C.S D.Na2S
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.盐酸与碳酸钡反应:CO32-+2H+===CO2↑+H2O
B.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-===BaSO4↓+Cu(OH)2↓
C.硝酸银溶液中加入铜粉:Ag++Cu===Cu2++Ag↓
D.铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
难度: 简单查看答案及解析
-
下列碱性透明溶液中,能大量共存的离子组是
A.K+、Na+、MnO4-、Cl- B.K+、Ag+、NO3-、Cl-
C.Ba2+、Na+、Cl-、SO42- D.Na+、Cu2+、NO3-、Cl-
难度: 简单查看答案及解析