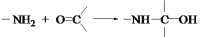-
下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是( )
A. 将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4
B. 将TiCl4加入水中并加热使其转化为TiO2•xH2O
C. 将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3
D. 将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀
难度: 中等查看答案及解析
-
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜器出现铜绿[Cu2(OH)2CO3] B.铁制菜刀生锈
C.大理石雕像被酸性较强的雨腐蚀毁坏 D.食物的腐败
难度: 简单查看答案及解析
-
下列事实与所对应的离子方程式正确的是
A.室温下,测定醋酸钠溶液的pH > 7:CH3COONa === CH3COO-+Na+
B.实验室用氯化铝溶液和氨水制备氢氧化铝:Al3+ +3OH- === Al(OH)3↓
C.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3 + 2H+ === SO2 ↑ + S↓+ 2Na+ + H2O
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s) + CO32-(aq) === CaCO3(s) + SO42-(aq)
难度: 简单查看答案及解析
-
下列化学用语或图示表达正确的是
A.乙烯的比例模型:

B.质量数为16的O原子:16O
C.氯离子的结构示意图:
D.CO2的电子式:
难度: 简单查看答案及解析
-
如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是( )
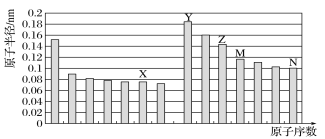
A.M在周期表中的位置为:第三周期,IV族
B.Y、Z、M、N四种元素形成的原子半径最大的是Y
C.X、N两种元素的气态氢化物的沸点相比,前者较低
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1:1
难度: 中等查看答案及解析
-
氨是化肥工业和基本有机化工的主要原料,工业采用N2和H2合成氨的催化过程如下图所示。已知合成氨的反应为放热反应,下列说法正确的是
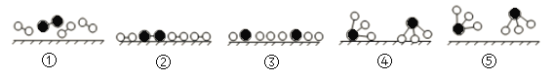
A.使用催化剂可改变反应的△H
B.过程③到④形成N—H吸收能量
C.升高温度,合成氨反应的平衡常数减小
D.催化剂可有效提高反应物的平衡转化率
难度: 中等查看答案及解析
-
温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是( )
t/min
2
4
7
9
n(Y)/mol
1.2
1.1
1.0
1.0
A.反应0~4min的平均速率v(Z)=0.25 mol·L-1·min-1
B.T1时,反应的平衡常数K1=1.2
C.其他条件不变,9min后,向容器中再充入1.6molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D.其他条件不变,若降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
难度: 中等查看答案及解析
-
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g)+
O2(g)= CO2(g) ∆H=-283.0 kJ/mol
S(g)+O2(g)=SO2(g) ∆H=-296.0 kJ/mol
下列说法不正确的是
A.放热反应不一定是自发反应
B.CO2与SO2可以用澄清石灰水鉴别
C.CO2分子中各原子最外层均为8电子稳定结构
D.相同条件下:2CO(g)+SO2(g)=S(g)+2CO2 (g) ∆H=-270kJ/mol
难度: 中等查看答案及解析
-
电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原理如下图所示。下列说法不正确的是
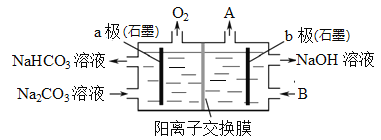
A.b极为阴极,产生的气体A为H2
B.溶液中的Na+通过交换膜由b极室到a极室
C.B可以使用稀NaOH溶液,其效果优于纯水
D.a极电极反应为4CO32-+2H2O-4e-=4HCO3-+O2↑
难度: 困难查看答案及解析
-
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项
①中物质
②中物质
预测②中的现象
A.
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B.
浓硝酸
用砂纸打磨过的铁片
产生红棕色气体
C.
氯化铵溶液
氢氧化镁沉淀
白色沉淀溶解
D.
碳酸氢钠溶液
苯酚钠溶液
溶液变浑浊
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
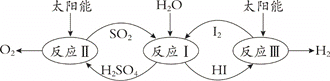
相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq);ΔH1 =﹣213 kJ·mol-1
反应II:H2SO4(aq) =SO2(g) + H2O(l) +1/2O2(g);ΔH2 = +327 kJ·mol-1
反应III:2HI(aq) =H2(g) + I2(g); ΔH3 = +172 kJ·mol-1
下列说法不正确的是( )
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学方程式为:2H2O(l)=2H2 (g)+O2(g);ΔH = +286 kJ·mol-1
D.该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
难度: 简单查看答案及解析
-
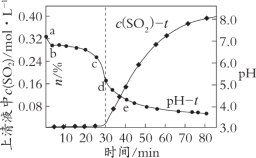
某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。

查阅资料,平衡I:Cu(OH)2 + 4NH3
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH-
[Cu(OH-)4]2-
项目
废水水质
排放标准
pH
1.0
6~9
Cu2+/ mg·L-1
72
≤0.5
NH4+/ mg·L-1
2632
≤15
下列说法不正确的是
A.废水中Cu2+处理的最佳pH约为9
B.b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
难度: 中等查看答案及解析
-
已知常温下,3种物质的电离平衡常数如下表:
物质
HCOOH
CH3COOH
NH3·H2O
电离平衡常数K
1.77×10−4
1.75×10−5
1.76×10−5
下列说法不正确的是
A.常温下,足量HCOOH溶液与Na2CO3溶液反应可生成无色气体
B.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.pH均为3的HCOOH和CH3COOH溶液, c(HCOOH)>c(CH3COOH)
难度: 困难查看答案及解析
-
为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是

A. Mg(OH)2浊液中存在:Mg(OH)2(s)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3•H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
难度: 中等查看答案及解析