-
工业上从海水中提取溴单质时,可用纯碱溶液吸收空气吹出的溴,发生反应:
(I )3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2;
(II )5NaBr+NaBrO3 +3H2SO4 ===3Na2SO4 +3Br2+3H2O
下列有关判断正确的是
A. 反应I中氧化剂与还原剂的物质的量之比为1:1
B. 溴元素由化合态转化成游离态时一定发生了还原反应
C. 反应Ⅱ中生成3 mol Br2时,必有5 mol电子转移
D. 氧化还原反应中化合价变化的元素一定是不同种元素
难度: 中等查看答案及解析
-
下列实验叙述错误的是
A. 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,说明原溶液中有Na+而无法判断是否有K+
B. 配制硫酸铁溶液时,将硫酸铁溶解在硫酸中,再加水稀释
C. 中和滴定时,滴定管用蒸馏水洗涤2~3次后即可加入标准溶液进行滴定
D. 向某钠盐 X 的溶液中先滴加稀盐酸,无现象,再滴加 BaCl2 溶液,出现白色沉淀,X 不一定是Na2SO4
难度: 中等查看答案及解析
-
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是
A.蒸馏 B.升华 C.干馏 D.萃取
难度: 简单查看答案及解析
-
北宋沈括的《梦溪笔谈》对指南针已有详细记载:“方家以磁石磨针锋,则能指南。”磁石的主要成分( )
A.Fe3O4 B.Fe2O3 C.FeO D.CuFeS2
难度: 简单查看答案及解析
-
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物
B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
C.漂白粉、福尔马林、冰水、王水、氯水均为混合物
D.Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物
难度: 中等查看答案及解析
-
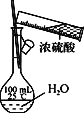
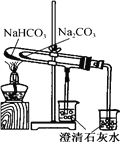
下列实验操作正确的是
A. 制备无水氯化铁

B. 配制一定浓度的硫酸溶液
C. 制取少量NH3

D. 比较NaHCO3和Na2CO3的热稳定性
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124gP4中所含P—P键数目为4NA
B. 100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列叙述正确的是
A.1mol 乙烷和1mol乙烯中,化学键数相同
B.同等质量的氧气和臭氧中,电子数相同
C.1mol重水和1mol水中,中子数比为2:1
D.24g镁和27g铝中,含相同的质子数
难度: 中等查看答案及解析
-
常温下,下列离子在指定溶液中一定能大量共存的是( )
A.能使KSCN变红的溶液:Na+、Mg2+、SO42-、I-
B.甲基橙显黄色的溶液:NH4+、Na+、NO3-、Cl-
C.0.10mol/L的明矾溶液:K+、Ca2+、Cl-、HCO3-
D.使酚酞变红的溶液:K+、Na+、NO3-、CO32-
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+=Fe3++3H2O
B.用氨水溶解氢氧化铜沉淀:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
C.用稀硝酸除去试管内壁上的银:3Ag+4H++NO3-=3Ag++NO↑+2H2O
D.向NaClO溶液中通入过量的SO2:SO2+NaClO+H2O=HClO+NaHSO3
难度: 简单查看答案及解析
-
黑火药着火爆炸,发生如下化学反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,该反应的还原剂是( )
A.KNO3 B.S C.C D.S、C
难度: 简单查看答案及解析
-
下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是( )
选项
X
Y
Z
A
Al
NaAlO2(aq)
Al(OH)3
B
MgO
MgCl2(aq)
Mg
C
H2O(g)
Fe3O4
Fe
D
NaOH(aq)
Na2CO3(aq)
NaHCO3(aq)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是( )

A.配制稀硫酸定容时俯视刻度线会造成所配溶液浓度偏高
B.取该硫酸1ml与1ml水混合后,物质的量浓度为9.2mol/L
C.将该硫酸配成1mol/L的稀硫酸480ml所需的玻璃仪器只有:烧杯、500ml容量瓶、玻璃棒
D.1molFe与足量的该硫酸反应产生1mol氢气
难度: 中等查看答案及解析
-
下列实验现象和结论都正确的是( )
选项
实验操作
实验现象
结论
A
将SO2气体通入Ba(NO3)2溶液
有白色沉淀
SO2中混有SO3
B
向NaAlO2溶液中持续通入气体Y
先出现白色沉淀,最终沉淀又溶解
Y可能是CO2气体
C
向某溶液中滴入氯水,再滴加KSCN
溶液显红色
原溶液中一定有Fe2+
D
a向淀粉KI溶液中滴入3滴稀硫酸
b再加入10%的H2O2溶液
a未见溶液变蓝
b溶液立即变蓝色
证明酸性条件下H2O2氧化性强于I2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)在有机合成中非常重要,可发生如下反应:①LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑②NaBH4+NH4Cl=NH3BH3+NaCl+H2↑,则下列说法错误的是 ( )
A.LiAlH4中H元素为-1价
B.反应②中,每生成1 mol NH3BH3会转移2 mol e-
C.两个反应中,H2均既是氧化产物,又是还原产物
D.NH4Cl和NaBH4所含化学键类型相同
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是 ( )
选项
已知
类推
A
向Ca(OH)2悬浊液中通入Cl2:
Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O
向CaCO3悬浊液中通入Cl2:
Cl2+CaCO3=Ca2++Cl-+ClO-+CO2↑
B
向氯化铝溶液中加入足量NaOH溶液:
Al3++4OH-=[Al(OH)4]-
向氯化铝溶液中加入足量氨水:
Al3++4NH3·H2O=[Al(OH)4]-+H2O+4NH4+
C
FeCl2溶液中滴入氯水:
2Fe2++Cl2===2Fe3++2Cl-
向FeCl2溶液中滴入碘水:
2Fe2++I2===2Fe3++2I-
D
向Ca(OH)2溶液中通入过量CO2:
CO2+OH-===HCO3-
向Ca(OH)2溶液中通入过量SO2:
SO2+OH-===HSO3-
A.A B.B C.C D.D
难度: 中等查看答案及解析