-
化学与生产、生活、社会密切相关。下列有关说法中错误的是( )
A.国产大客机C919大规模使用先进的材料铝锂合金,该合金密度小,强度高
B.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
C.鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排
D.我国在南海成功开采的可燃冰(CH4•nH2O)不会带来酸雨等环境污染
难度: 简单查看答案及解析
-
某些能源关系如图所示,以下选项中全部符合图中阴影部分能源的是( )
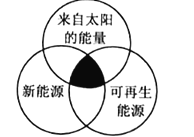
A.煤炭、地热能、潮汐能 B.水能、生物质能、天然气
C.太阳能、风能、生物质能 D.石油、海洋能、核能
难度: 简单查看答案及解析
-
自然条件下的大气固氮过程中,不会产生的物质是( )
A.NO B.NO2 C.HNO3 D.NH3
难度: 简单查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:4Ag+2H2S+O2=2X+2H2O,下列说法错误的是( )
A.反应中Ag和H2S均是还原剂 B.银针验毒时,空气中氧气得电子
C.X的化学式为Ag2S D.当有1molH2S参加反应时,转移2mole-
难度: 中等查看答案及解析
-
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析错误的是( )
A.镓元素为第四周期第ⅢA元素
B.原子半径:Br>Ga
C.79Br与81Br得电子能力相同
D.碱性:Ga(OH)3>Al(OH)3,酸性:HClO4>HBrO4
难度: 中等查看答案及解析
-
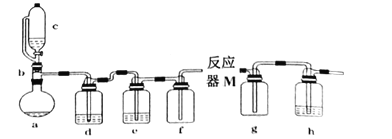
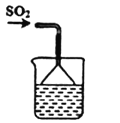
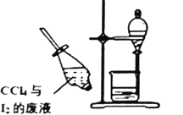
依据反应2NaIO3+5SO2+4H2O═I2+3H2SO4+2NaHSO4,利用下列装置分四步从含NaIO3的废液中制取单质碘的CCl4溶液,并回收NaHSO4。其中装置错误的是( )
A.
 制取SO2
制取SO2B.
 还原IO3-
还原IO3-C.
 制I2的CCl4溶液
制I2的CCl4溶液D.
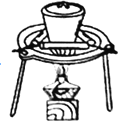 从水溶液中提取NaHSO4
从水溶液中提取NaHSO4难度: 中等查看答案及解析
-
下列说法正确的是( )
A.粗铜电解精炼时,纯铜作阴极,电极反应为Cu2++2e-=Cu
B.5.6gFe在足量Cl2中充分燃烧,转移电子的数目约为0.2×6.02×1023
C.室温下,稀释0.1moL氨水(NH3•H2O),溶液中
变大
D.向H2O2溶液中滴入NaClO溶液,产生无色气体,证明H2O2具有氧化性
难度: 中等查看答案及解析
-
由废铁屑制Fe2O3的一种流程如图:下列说法错误的是( )
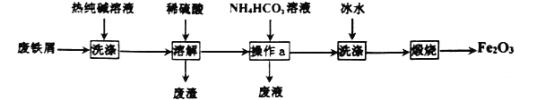
A.废液中一定含有NH4+
B.操作a是过滤
C.冰水只有洗去杂质的作用
D.Fe2O3俗名铁红,可用作红色颜料
难度: 中等查看答案及解析
-
对下列现象或事实的解释正确的是( )
现象或事实
解释
A
SO2在工业上常用来漂白纸浆、毛丝、草帽辨等
SO2具有还原性
B
K2FeO4用于自来水的消毒和净化
Fe3+水解生成胶状物,有消毒和净化作用
C
Na2O2用于呼吸面具中作为O2的来源
Na2O2是强氧化剂,能氧化CO2生成O2
D
常温下可用铁、铝制容器盛装浓硫酸或浓硝酸
铁、铝表面被氧化为致密的氧化物薄膜,阻止了酸与内层金属的进一步反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在12.0gNaHSO4晶体中,所含离子数目为0.3NA
B.50℃时,1LpH=1的H2SO4溶液中,含有H+的数目为0.1NA
C.常温下,在c(H+)=1×10-13mol·L-1的溶液中存在的离子有:Na+、Al3+、SO42-、NO3-
D.在溶质为KNO3和NaHSO4的溶液中存在的离子有:Fe2+、Ca2+、Al3+、Cl-
难度: 中等查看答案及解析
-
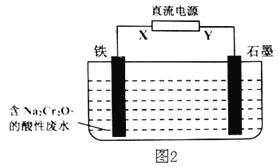
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析错误的是( )
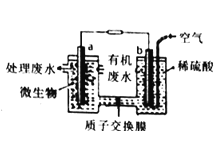
A.a是负极,b是正极,电子流动方向为a→导线→b
B.H+经质子交换膜由左向右移动
C.b的电极反应式为:O2+4e-+2H2O=4OH-
D.a的电极反应式为:H2N(CH2)2NH2-16e-+4H2O=2CO2↑+N2↑+16H+
难度: 中等查看答案及解析
-
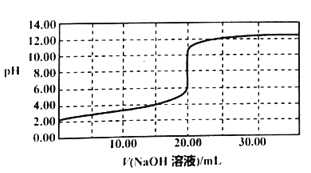
常温下,用0.1000mol/LNaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=1.0×10-4)
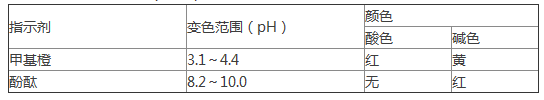
提示:几种常见的酸碱指示剂变色范围如下:
下列有关叙述正确的是( )
A.当加入10.00mLNaOH溶液时,溶液中:c(HCOO-)>c(Na+)>c(HCOOH)
B.加入5.00mLNaOH溶液和加入25.00mLNaOH溶液时,水的电离程度相同
C.当加入20.00mLNaOH溶液时,溶液pH=8.0
D.该滴定过程中选择甲基橙试液作为指示剂
难度: 中等查看答案及解析