-
废弃铝制易拉罐应投入的垃圾桶上贴有的垃圾分类标志是( )




A
B
C
D
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
我国古代文献中有许多化学知识的记载,如《梦溪笔谈》中的“信州铅山县有苦泉,……,挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜”等,上述描述中没有涉及的化学反应类型是
A. 复分解反应 B. 化合反应
C. 离子反应 D. 氧化还原反应
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的数值。下列说法正确的是( )
A.18gD2O含有的电子数为10NA
B.常温常压下,124gP4中所含P—P键数目为4NA
C.标准状况下,11.2LO2和CO2混合气体含有的氧原子数为NA
D.将23gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
难度: 简单查看答案及解析
-
化学与生产、生活和社会密切相关。下列有关说法正确的是( )
A.食品袋中放置的CaO可防止食品氧化变质
B.华为继麒麟980之后自主研发的7m芯片问世,芯片的主要成分是二氧化硅
C.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
D.SO2具有漂白性可用来漂白纸浆、毛、丝、草帽辫
难度: 简单查看答案及解析
-
2019年为国际化学元素周期表年。鉝(Lv)是116号主族元素。下列说法不正确的是( )
A.Lv位于第七周期第ⅥA族 B.Lv在同主族元素中金属性最弱
C.Lv的同位素原子具有相同的电子数 D.中子数为177的Lv核素符号为
Lv
难度: 简单查看答案及解析
-
下列实验合理的是( )
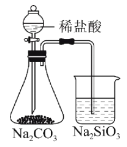
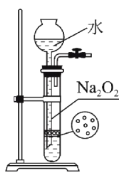
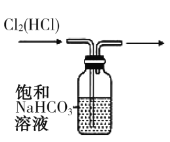
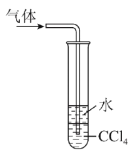
A.证明非金属性Cl>C>Si
B.制备少量氧气
C.除去Cl2中的HCl
D.吸收氨气,并防止倒吸
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2 Al+2OH-=AlO2-+H2↑
B.电解饱和食盐水制备Cl2 2Cl-+2H2O
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸 Ba2++OH-+H++ SO42-=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水 Ca2++HCO3-+OH-=CaCO3↓+H2O
难度: 简单查看答案及解析
-
下列实验操作规范且能达到实验目的是( )
选项
实验目的
实验操作
A
除去KNO3中混有NaCl
将固体混合物溶于水后蒸发结晶,过滤
B
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和的FeCl3溶液中
C
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:
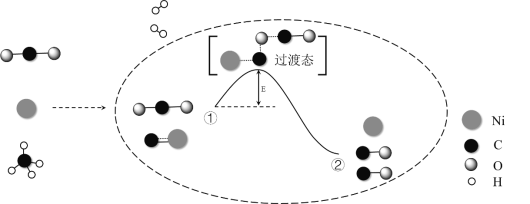
下列说法不正确的是
A. 合成气的主要成分为CO和H2
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. ①→②吸收能量
D. Ni在该反应中做催化剂
难度: 困难查看答案及解析
-
海水是巨大的资源宝库,从海水中可以提取镁、溴等产品。某兴趣小组以MgBr2为原料,模拟从海水中制备溴和镁。下列说法错误的是( )
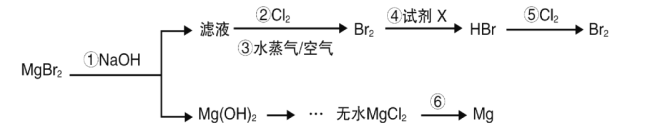
A.工业上步骤①常用Ca(OH)2代替NaOH
B.设计步骤②、③、④的目的是为了富集溴
C.步骤④中试剂X可选用饱和二氧化硫水溶液
D.工业上实现步骤⑥,通常用氢气还原氯化镁
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物是一种清洁能源,X的氧化物是形成酸雨的主要物质之一,Y是非金属性最强的元素,Z的原子半径是所有短周期元素中最大的。下列说法不正确的是( )
A.W、X、Y的最高价氧化物对应对应水化物的酸性Y>X>W
B.Y的简单氢化物的热稳定性比W的强
C.元素X、Y、Z的简单离子半径依次减小
D.W与Y两种元素可以形成共价化合物
难度: 简单查看答案及解析
-
A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,可以发生如下转化(水参与的反应,水未标出)。
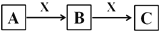
下列说法不正确的是
A.若A、B、C的焰色反应呈黄色、水溶液均呈碱性,则X可以是CO2
B.若C为红棕色气体,则A一定为空气中含量最高的气体
C.若B为FeCl3,则X一定是Fe
D.A可以是碳单质,也可以是O2
难度: 中等查看答案及解析
-
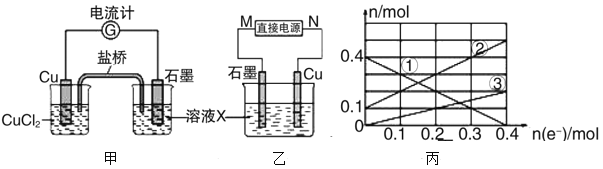
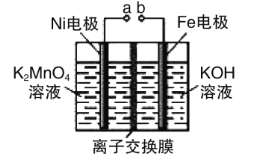
碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法不正确的是( )
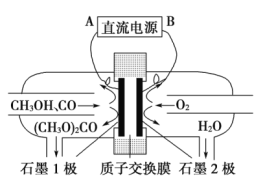
A.石墨2极与直流电源负极相连
B.石墨1极发生的电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+
C.H+由石墨1极通过质子交换膜向石墨2极移动
D.电解一段时间后,阴极和阳极消耗的气体的物质的量之比为2:1
难度: 简单查看答案及解析
-
某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、 Cu2+、Br-、AlO2-、Cl-、SO42-、CO32-,现进行如下实验:
① 用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出。将溶液分为3份。
② 在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清。加热,将湿润的红色石蕊试纸置于试管口,未见明显现象。
③ 在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色。
则下列推断正确的是:
A.溶液中一定有K+、Br-、AlO2-、CO32-
B.溶液中一定没有NH4+、Mg2+、Cu2+、Cl-
C.不能确定溶液中是否有K+、Cl-、SO42-
D.往第3份溶液中滴加硝酸酸化的硝酸银溶液可确认是否有Cl-
难度: 困难查看答案及解析
-
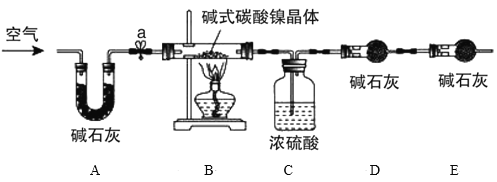
为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
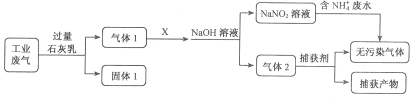
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
难度: 中等查看答案及解析
-
1.52g铜镁合金完全溶解于50mL浓度14.0mol/L的硝酸中,得到NO2和N2O4的混合气体1120ml(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时得到2.54g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.NO2和N2O4的混合气体中,NO2的体积分数是80%
C.得到2.54g沉淀时加入NaOH溶液的体积是600mL
D.溶解合金消耗HNO3的量是0.12mol
难度: 中等查看答案及解析
-
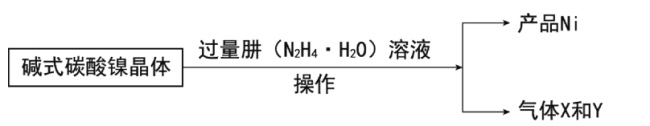
Fe3O4中含有
、
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
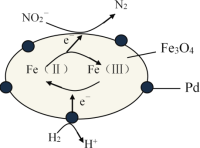
A.Pd上发生的电极反应为:H2 - 2e- 2H+
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被Fe(Ⅱ)还原为N2
D.用该法处理后水体的pH降低
难度: 困难查看答案及解析