-
“以曾青涂铁。铁赤色如铜"——东晋.葛洪。下列有关解读正确的是
A.铁与铜盐发生氧化还原反应. B.通过化学变化可将铁变成铜
C.铁在此条件下变成红色的Fe2O3 D.铜的金属性比铁强
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是
A.1mol葡萄糖和果糖的混合物中含羟基数目为5NA
B.500 mL1 mol .L -1(NH4)2SO4溶液中NH4+数目小于0.5 NA
C.标准状况下,22.4 L1,2-二溴乙烷含共价键数为7 NA
D.19.2 g铜与硝酸完全反应生成气体分子数为0. 2 NA
难度: 中等查看答案及解析
-
Z是合成某药物的中间体,其合成原理如下:
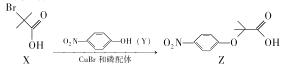
下列说法正确的是.
A.用NaHCO3溶液可以鉴别X和Z B.X、Y、Z都能发生取代反应
C.X分子所有碳原子可能共平面 D.与X具有相同官能团的同分异构体还有5种
难度: 中等查看答案及解析
-
AlCl3常作净水剂。某小组选择如下装置制备氯化铝,已知氯化铝易升华,遇水易水解。下列说法错误的是

A.按气流方向从左至右,装置连接顺序为a→c→b→d
B.先启动a中反应,当硬质试管内充满黄绿色时点燃酒精灯
C.试剂R为P2O5或CaCl2 吸收空气中的水蒸气
D.为了中止反应,停止通入Cl2的操作是关闭分液漏斗的活塞
难度: 中等查看答案及解析
-
常温下,向20 mL0.1 mol. L-1HN3(叠氮酸)溶液中滴加pH=13的NaOH溶液,溶液中水电离的c(H+)与NaOH溶液体积的关系如图所示(电离度等于已电离的电解质浓度与电解质总浓度之比)。下列说法错误的是

A.HN3是一元弱酸
B.c点溶液中:c(OH-) =c(H+) +c( HN3)
C.常温下,b、d点溶液都显中性
D.常温下,0.1 mol. L-1 HN3溶液中HN3的电离度为10a-11 %
难度: 困难查看答案及解析
-
JohnBGoodenough是锂离子电池正极材料钴酸锂的发明人。某种钻酸锂电池的电解质为LiPF6,放电过程反应式为xLi + Li-xCoO2= LiCoO2。 工作原理如图所示,下列说法正确的是
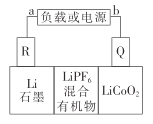
A.放电时,电子由R极流出,经电解质流向Q极
B.放电时,正极反应式为xLi+ +Li1-xCoO2 +xe-=LiCoO2
C.充电时,电源b极为负极
D.充电时,R极净增14g时转移1mol电子
难度: 中等查看答案及解析
-
短周期主族元素R、X、Y、Z的原子序数依次增大,R和X组成简单分子的球棍模型如图所示。Y原子核外K、M层上电子数相等,Z原子最外层电子数是电子层数的2倍。下列推断正确的是
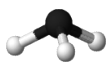
A.原子半径:Y>Z>R>X
B.Y3X2是含两种化学键的离子化合物
C.X的氧化物对应的水化物是强酸
D.X和Z的气态氢化物能够发生化合反应
难度: 中等查看答案及解析
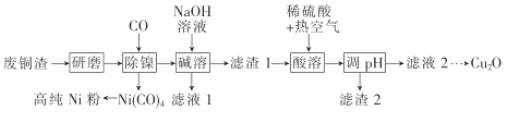
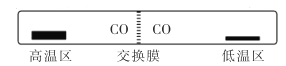
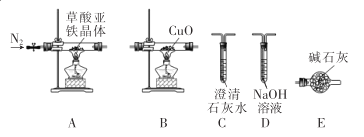






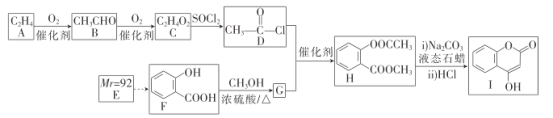
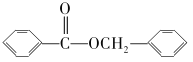 ,设计合成方案:________。
,设计合成方案:________。