-
FeC2O4·2H2O是一种淡黄色粉末,加热分解生成FeO、CO、CO2 和H2O。某小组拟探究其分解部分产物并测定其纯度。
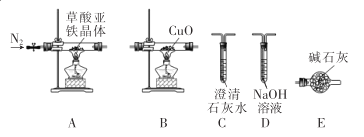
回答下列问题:
(1)按气流方向从左至右,装置连接顺序为A、___________C( 填字母,装置可重复使用)。
(2)点燃酒精灯之前,向装置内通入一段时间N2,其目的是__________________。
(3)B中黑色粉末变红色,最后连接的C中产生白色沉淀,表明A中分解产物有_________。
(4)判断A中固体已完全反应的现象是_____________。设计简单实验检验A中残留固体是否含铁粉:________。
(5)根据上述装置设计实验存在的明显缺陷是________________________________。
(6)测定FeC2O4·2H2O样品纯度(FeC2O4·2H2O相对分子质量为M):准确称取w g FeC2O4·2H2O样品溶于稍过量的稀硫酸中并配成250mL溶液,准确量取25.00mL所配制溶液于锥形瓶,用c mol ·L—1标准KMnO4溶液滴定至终点,消耗V mL滴定液。滴定反应为FeC2O4+ KMnO4+ H2SO4→K2SO4+MnSO4 +Fe2(SO4)3+CO2↑+ H2O(未配平)。则该样品纯度为_______% (用代数式表示)。若滴定前仰视读数,滴定终点俯视读数,测得结果_____ (填“偏高”“偏低”或“无影响”)。
-
草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。

下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 通入N2的主要目的是防止空气中的CO2对产物检验产生影响
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉未完全变成黑色,则产物一定为铁
-
草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。

下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
-
草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
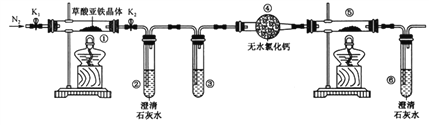
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
-
草酸亚铁晶体(化学组成为FeC2O4·2H2O)是一种淡黄色晶体粉末,是生产锂电池的原材料。已知FeC2O4·2H2O在300 ℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物。某学习小组欲验证草酸亚铁晶体的分解产物。
I.甲组同学设计了如下实验装置:
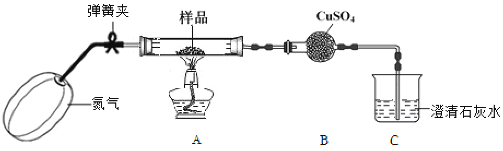
(1)实验开始前,鼓入氮气排出空气的目的是_____________________________。
(2)检验水和二氧化碳的装置分别是_______和_______。
(3)设计实验验证装置A中黑色残留物不含有Fe3O4_______________________________________________________________(简要说明实验操作,现象和结论)。
II.乙组同学选用甲组实验中的装置A(接口用x表示)和下图所示的装置(可以重复选用)验证分解产物CO。

(4)乙组同学的实验装置中,依次连接的合理顺序为x→______g→h→a(用接口字母和“→”表示)。装置G反应管中盛有的物质是氧化铜。能证明草酸晶体分解产物中有CO的现象是___________。
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是________________________。
-
草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
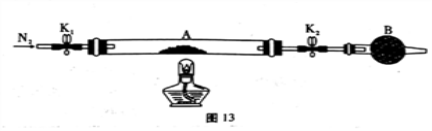
(1)甲组同学用图13所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
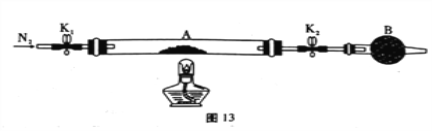
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯加热;
c.熄灭酒精灯;
d.冷却至室温;
e.关闭K1和K2;
f.称重A;
g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是____________________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。
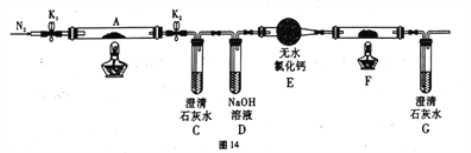
①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有_______________(填化学式)。
②装置F中盛放的物质是:______________________ (填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中有:_________________ (填化学式)。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
-
草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
(1)甲组同学用图13所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯加热;
c.熄灭酒精灯;
d.冷却至室温;
e.关闭K1和K2;
f.称重A;
g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是____________________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。
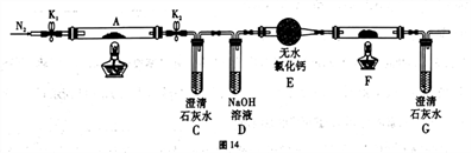
①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有_______________(填化学式)。
②装置F中盛放的物质是:______________________ (填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中有:_________________ (填化学式)。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
-
草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和制药工业,某化学兴趣小组对其性质进行如下探究。回答下列问题:
Ⅰ.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4 溶液、H2O2 溶液、KSCN 溶液
| 操作 | 现象 | 结论与解释 |
| (1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静 置 | 有淡黄色沉淀,上层清液无色 | ___________________________ |
| (2)继续加入2mL稀硫酸,振荡 | 固体溶解,溶液变为浅绿色 | 草酸亚铁溶于硫酸,硫酸酸性____草酸(填“强于”、“弱于”或“等于”) |
| (3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | ___________ | 含有Fe2+ |
| (4)________________________________ | ___________ | H2C2O4 或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x 的值
(5)滴定前,下列操作的正确顺序是c→ _________ →d(填字母序号)。
a.排尽滴定管尖嘴的气泡并调整液面 b.盛装0.1000 mol·L-1 的酸性KMnO4 溶液
c.查漏、清洗 d.初始读数、记录为0.50 mL
e.用0.1000 mol·L-1 的酸性KMnO4 溶液润洗
(6)称取 m 克样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4 溶液直接滴定,溶解时最适合的玻璃仪器是_______________ ,滴定反应的氧化产物是________________。
(7)终点读数为20.50mL。结合上述实验数据求得x=____________(用含m 的代数式表示,FeC2O4 的相对分子质量为144)。
-
草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和制药工业,某化学兴趣小组对其性质进行如下探究。回答下列问题:
Ⅰ.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4 溶液、H2O2 溶液、KSCN 溶液
| 操作 | 现象 | 结论与解释 |
| (1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静 置 | 有淡黄色沉淀,上层清液无色 | ___________________________ |
| (2)继续加入2mL稀硫酸,振荡 | 固体溶解,溶液变为浅绿色 | 草酸亚铁溶于硫酸,硫酸酸性____草酸(填“强于”、“弱于”或“等于”) |
| (3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | ___________ | 含有Fe2+ |
| (4)________________________________ | ___________ | H2C2O4 或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x 的值
(5)滴定前,下列操作的正确顺序是c→ _________ →d(填字母序号)。
a.排尽滴定管尖嘴的气泡并调整液面 b.盛装0.1000 mol·L-1 的酸性KMnO4 溶液
c.查漏、清洗 d.初始读数、记录为0.50 mL
e.用0.1000 mol·L-1 的酸性KMnO4 溶液润洗
(6)称取 m 克样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4 溶液直接滴定,溶解时最适合的玻璃仪器是_______________ ,滴定反应的氧化产物是________________。
(7)终点读数为20.50mL。结合上述实验数据求得x=____________(用含m 的代数式表示,FeC2O4 的相对分子质量为144)。
-
草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组对其性质进行如下探究,回答下列问题:
I.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4溶液、K3[Fe(CN)6]溶液
| 操作 | 现象 | 结论与解释 |
| (1)取少量草酸亚铁晶体于试管中,加入2mL水,振荡后静置 | 有淡黄色沉淀,上层清液无色 | 草酸亚铁不溶于水 |
| (2)继续加入2mL稀硫酸,振荡 | ___________ | 草酸亚铁溶于硫酸,硫酸酸性强于草酸 |
| (3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ___________ |
| (4)①___________ | ②___________ | H2C2O4或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x的值
(5)滴定前,下列操作的正确顺序是___________(填字母序号)。
a.用0.1000mol/L的酸性KMnO4溶液润洗
b.查漏、清洗
c.排尽滴定管尖嘴的气泡并调整液面
d.盛装0.1000mol/L的酸性KMnO4溶液
e.初始读数、记录为0.50mL
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,如何判断滴定终点?_______________。
(7)终点读数为20.50mL。结合上述实验数据求得x=___________(用含n的代数式表示,FeC2O4的相对分子质量为144)。









