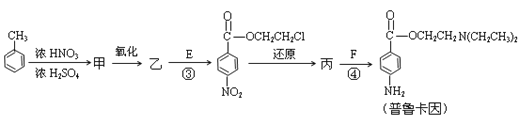
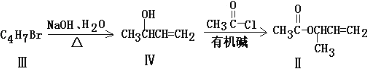
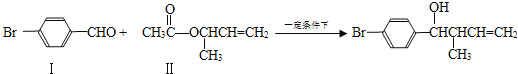-
请用所学有机化学知识判断下列表述,其中正确的是( )
A. 用大米酿造的酒在一定条件下密封保存,时间越长越香醇
B. 欲将蛋白质从溶液中析出而又不改变它的性质,可加CuSO4溶液
C. 乙烯使溴水褪色与苯使溴水褪色的原因相同
D. 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应高温
难度: 中等查看答案及解析
-
人类在未来将逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法错误的是:
A. 煤、石油和天然气都属于碳素燃料
B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池可将太阳能直接转化为电能
D. 目前研究菠菜蛋白质“发电”不属于“太阳能文明”
难度: 简单查看答案及解析
-
对某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的平衡转化率
B.同等程度改变正逆反应速率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
难度: 简单查看答案及解析
-
据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C—C≡C—C≡C—C≡C—C≡N。下列对该物质的判断正确的是( )
A.属于不饱和烃 B.不能使酸性KMnO4溶液褪色
C.所有原子都在同一条直线上 D.可由乙炔和含氮化合物加聚制得
难度: 中等查看答案及解析
-
能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠 B.加入NaHCO3固体
C.向水中加入CH3COONa晶体 D.向水中加入NH4Cl溶液
难度: 简单查看答案及解析
-
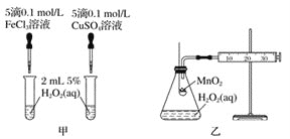
下列实验能成功的是( )
A.将乙酸和乙醇混合加热制乙酸乙酯
B.苯和浓溴水反应制溴苯
C.CH3CH2Br中滴加AgNO3溶液观察是否有淡黄色沉淀,判断卤代烃的类型
D.用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热
难度: 中等查看答案及解析
-
进入2013年以来,我国中东部地区曾出现严重的雾霾天气。下列有关防治雾霾天气的说法不正确的是 ( )。
A.开发利用太阳能、生物质能等清洁能源
B.充分开发利用纯天然纤维,停止使用各种化学合成材料
C.积极发展公共交通,倡导绿色出行
D.研制开发燃料电池汽车
难度: 简单查看答案及解析
-
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)=Z(OH)2+H2↑;
④水溶液中,X+Y2+=X2++Y。
则这五种金属的活动性由强到弱的顺序为( )
A. Z>X>Y>M>N B. Z>Y>X>M>N
C. Z>X>Y>N>M D. X>Y>M>N>Z
难度: 中等查看答案及解析
-
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法不正确的是( )
A.负极反应式:Ag+Cl--e-=AgCl
B.正极反应式:5MnO2+2e-= Mn5O102-
C.每生成1 mol Na2Mn5O10转移2 mol电子
D.AgCl是还原产物
难度: 困难查看答案及解析
-
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向0.1 L 0.2 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1>ΔH3>ΔH2 C.ΔH1=ΔH3>ΔH2 D.ΔH1<ΔH3<ΔH2
难度: 中等查看答案及解析
-
下列物质中,不能发生消去反应的是
A.
 B.CH2CH2Br2
B.CH2CH2Br2C.
 D.CH2ClCH2CH3
D.CH2ClCH2CH3难度: 中等查看答案及解析
-
已知H2CO3的电离常数:K1=4.4×10-7,K2=4.7×10-11,HClO的电离常数:2.95×10-8。反应:Cl2+H2O
HCl+HClO达到平衡后,要使c(HClO)增大可加入( )
A.NaOH B.HCl C.CaCO3(固体) D.H2O
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:xA(g)+yB(g)
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
A.x+y﹥z B.平衡向右移动 C.B的转化率提高 D.C的体积分数降低
难度: 中等查看答案及解析
-
把有机物
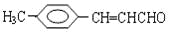 氧化为
氧化为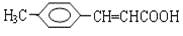 ,所用氧化剂最合理的是( )
,所用氧化剂最合理的是( )A.O2 B.酸性KMnO4 C.银氨溶液 D.溴水
难度: 中等查看答案及解析
-
破坏(或形成)1 mol化学键所吸收(或放出)的能量称为键能。已知 H—H 键的键能为 436 kJ·mol-1,O=O键的键能为 498 kJ·mol-1, H2(g)+
O2(g)=H2O(l) ΔH=-286 kJ·mol-1 , 则 H2O 分子中 O—H 键的键能为( )
A.485.5 kJ·mol-1 B.610 kJ·mol-1 C.917 kJ·mol-1 D.1 220 kJ·mol-1
难度: 简单查看答案及解析
-
与等物质的量的Br2发生加成反应,生成的产物是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )

A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
难度: 中等查看答案及解析
-
在相同温度下(T=500K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲 B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲 D.平衡时SO2的体积分数:乙>甲
难度: 中等查看答案及解析
-
下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化还原反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生能源
④燃烧时放出大量热量
A.①②③ B.①②④ C.①③④ D.②③④
难度: 简单查看答案及解析
-
某烷烃的结构简式为
,它的正确命名是( )
A. 4-甲基-3-乙基戊烷 B. 3-丙基戊烷
C. 2-甲基-3-乙基戊烷 D. 3-乙基-2-甲基戊烷
难度: 中等查看答案及解析
-
可逆反应:3A(g)
3B(?)+C(?) ΔH>0,随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C一定都不是气体
难度: 中等查看答案及解析
-
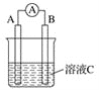
全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( )
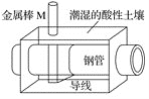
A.酸性土壤中的钢铁主要发生吸氧腐蚀
B.金属棒M的材料应该是比铁活泼的金属
C.金属棒M上发生反应:M-ne-=Mn+
D.这种方法称为牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体 D.小苏打溶液中加入少量NaCl固体
难度: 中等查看答案及解析
-
下列有关化学平衡常数的描述中正确的是( )
A.化学平衡常数的大小决定于化学反应的内因,与其他外界条件无关
B.相同温度下,反应A+B
C与反应C
A+B的化学平衡常数相同
C.反应2SO2(g)+O2(g)
2SO3(g) ΔH<0, 温度升高,此反应的化学平衡常数不变
D.反应A(g)+B(g)
2C(g)的平衡常数表达式为K=
难度: 中等查看答案及解析
-
已知:CO(g)+2H2(g)
CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如下图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是

A.加入催化剂,△H变小
B.△H=+91 kJ/mol
C.生成1molCH3OH(l)时,△H值增大
D.反应物的总能量大于生成物的总能量
难度: 简单查看答案及解析


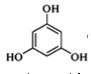 +2CH3OH
+2CH3OH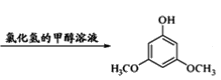 +2H2O
+2H2O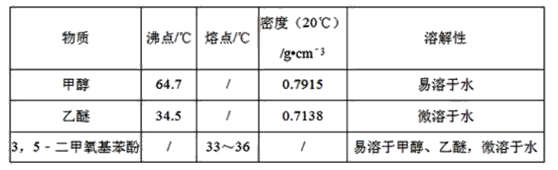
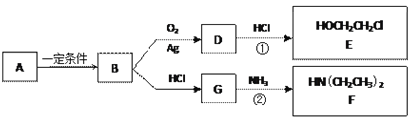
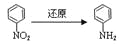 )
)