-
化学与生产、生活及社会发展密切相关,下列有关说法不正确的是
A. “血液透析”和“静电除尘”利用了胶体的不同性质
B. 氨基酸在人体中生成新的蛋白质的反应属于缩聚反应
C. 从海水中提取物质都必须通过化学反应才能实现
D. 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
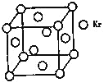
A.0.5mol雄黄(As4S4),结构如图,含有NA个S-S键
B.将1 mol NH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C.标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D.高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.6NA
难度: 简单查看答案及解析
-
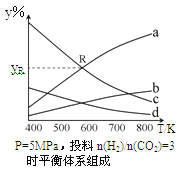
下图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是
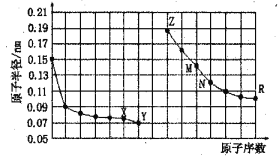
A.M、N的氧化物都能与Z、R的最高价氧化物对应水化物反应
B.Y的单质能从含R简单离子的水溶液中置换出R单质
C.X、M两种元素组成的化合物熔点很高
D.简单离子的半径:R>M>X
难度: 中等查看答案及解析
-
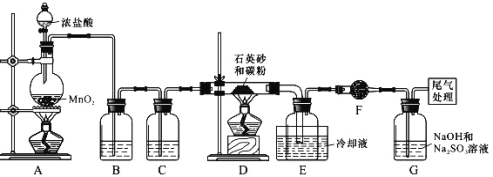
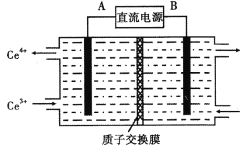
实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
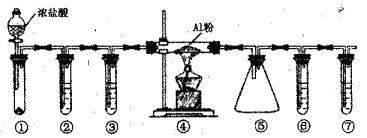
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
难度: 中等查看答案及解析
-
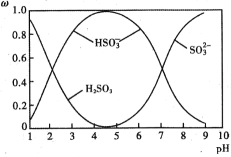
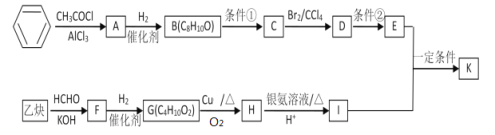
向0.1 mol∙L-1的NH4HCO3溶液中逐渐加入0.1 mol∙L-1NaOH 溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数a),根据图象下列说法不正确的是 ( )
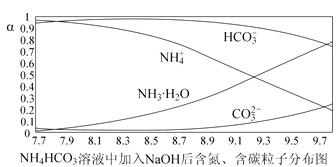
A.开始阶段,HCO3-反而略有增加,可能是因为 NH4HCO3 溶液中存在 H2CO3,发生的主要反应是 H2CO3+OH-=HCO3-+H2O
B.当 pH 大于 8.7 以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C.pH=9.5 时,溶液中 c(HCO3-)>c(NH3∙H2O)>c(NH4+)>c(CO32-)
D.滴加氢氧化钠溶液时,首先发生的反应:2NH4HCO3+2NaOH=(NH4)2CO3+Na2CO3
难度: 中等查看答案及解析
-
关于下列各实验装置的叙述中,错误的是 ( )
A.
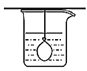 装置可用于分离蔗糖和葡萄糖,且烧杯中的清水应多次更换
装置可用于分离蔗糖和葡萄糖,且烧杯中的清水应多次更换B.
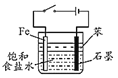 装置可用于制备少量 Fe(OH)2沉淀,并保持较长时间白色
装置可用于制备少量 Fe(OH)2沉淀,并保持较长时间白色C.
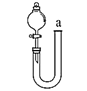 装置可用从a处加水的方法检验的气密性,原理为液差法
装置可用从a处加水的方法检验的气密性,原理为液差法D.
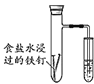 装置用于研究钢铁的吸氧腐蚀,一段时间后导管末端会进入一段水柱
装置用于研究钢铁的吸氧腐蚀,一段时间后导管末端会进入一段水柱难度: 中等查看答案及解析
-
相对分子质量为128的有机物A完全燃烧只生成CO2和H2O,若A含一个六碳环且可与NaHCO3溶液反应,则环上一氯代物的数目为()
A.2 B.3 C.4 D.5
难度: 困难查看答案及解析