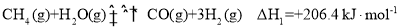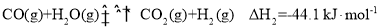-
下列民俗、诗句、谚语等包含吸热反应的是( )
A.民间焰火之最——确山打铁花 B.千锤万凿出深山,烈火焚烧若等闲
C.只要功夫深,铁杵磨成针 D.冰,水为之,而寒于水
难度: 简单查看答案及解析
-
2019年8月10日,受超强台风“利奇马”影响沿海多地发生泥石流灾害,造成重大损失,防疫部门对受灾地区开展消毒防疫工作。下列消毒使用的药品中属于电解质的是( )
A.漂白水 B.碘水 C.84消毒液 D.高锰酸钾
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.反应的热化学方程式的书写中,ΔH的大小与化学计量数无关
B.ΔH <0、ΔS <0的反应在高温时能自发进行
C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D.金属表面镀银时,应把镀件作为电镀池的阳极
难度: 简单查看答案及解析
-
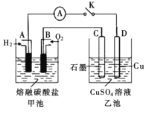
下列实验装置或操作设计正确,且能达到实验目的是( )
A.如图
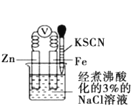 实验,验证牺牲阳极的阴极保护法
实验,验证牺牲阳极的阴极保护法B.如图
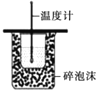 实验,进行中和热的测定
实验,进行中和热的测定C.如图
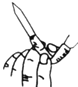 实验。排出碱式滴定管尖嘴部分的气泡
实验。排出碱式滴定管尖嘴部分的气泡D.如图
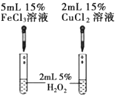 实验,比较
实验,比较和
对
分解的催化效果
难度: 简单查看答案及解析
-
下列化学用语对事实的表述正确的是( )
A.常温时,
氨水的pH=11:
B.电解精炼铜的阳极反应:
C.电解饱和食盐水:
D.甲烷的燃烧热
,则甲烷燃烧的热化学方程式可表示为:
难度: 简单查看答案及解析
-
和CO是环境污染性气体,一定温度下,可在
表面转化为无害气体,其反应原理为
。有关化学反应的物质变化过程及能量变化过程如下图所示。下列说法不正确的是( )
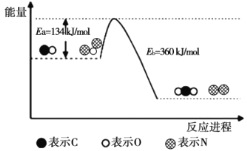
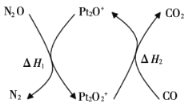
A.
B.
C.
能增大活化分子百分数,加快反应速率
D.该反应中反应物的总键能总和大于生成物的总键能总和
难度: 简单查看答案及解析
-
港珠澳大桥设计寿命达120年,对桥体钢构件采用的主要的防腐方法有:①铜梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不正确的是( )
A.①②防腐原理是牺牲阳极的阴极保护法
B.方法①②③只能减缓钢铁腐蚀,未能完全消除
C.钢铁发生吸氧腐蚀时的负极反应式为:
D.防腐涂料可以防水、隔绝空气,降低钢铁在海水中析氢腐蚀速率
难度: 简单查看答案及解析
-
美国学者成功实现在常温常压下用氮气和水生产氨,其装置如图所示,下列说法正确的是( )
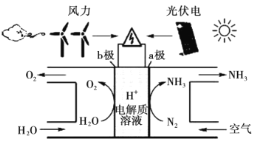
A.图中的能量转化方式只有2种
B.a极发生的电极反应为
C.装置工作时
向a极区移动
D.a极区与b极区产生的气体的物质的量之比为3:4
难度: 简单查看答案及解析
-
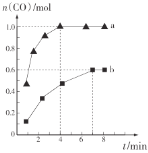
某温度下,在体积一定的密闭容器中进行如下反应:
,下列叙述正确的是( )
A.当容器内气体密度不随时间变化时,反应达到平衡
B.加入少量W,逆反应速率增大
C.在容器中充入He,可以提高Y的平衡转化率
D.降低温度,平衡逆向移动
难度: 简单查看答案及解析
-
下列有关盐类水解的相关描述中,不正确的是( )
A.中国古代利用明矾溶液清除铜镜表面的铜锈
B.
溶液中:
C.0.1 mol/L.醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后的溶液中:
D.物质的量浓度相等的①
;②
;③
三种溶液中,pH值由大到小的顺序为②>③>①
难度: 简单查看答案及解析
-
高炉炼铁过程中发生反应:
,该反应在不同温度下的平衡常数见表。下列说法正确的是( )
温度T/℃
1000
1150
1300
平衡常数K
4.0
3.7
3.5
A.平衡后温度不变缩小容器容积,
的转化率升高
B.增加高炉的高度可以有效降低炼铁尾气中CO的含量
C.其他条件不变时,增大c(CO),该反应的K值增大
D.由表中数据可判断该反应:反应物总能量大于生成物的总能量
难度: 简单查看答案及解析
-
用惰性电极电解下列溶液,电解一段时间后,再加入一定质量的另一种物质(括号中),能恢复成与原溶液完全一样的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
某含有铝电极的原电池工作时,电子从铝电极上流出,下列有关该电池另一种电极的材料与电解质溶液的选择肯定不符合题意的是( )
A.铜、稀盐酸 B.镁、NaOH溶液 C.铁、
溶液 D.锌、浓硝酸
难度: 简单查看答案及解析
-
在25℃时,向含有
、
的200 mL溶液中加入NaOH固体时,溶液中
、
随pH的变化曲线如图所示(忽略加人固体时溶液体积的变化)。下列叙述不正确的是( )
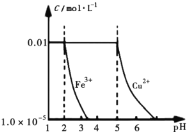
A.
B.
时溶液中的阳离子主要为
和
C.向含有
杂质的
溶液中加入CuO或
可除去溶液中混有的
D.当加入0.03 mol NaOH时,
、
完全沉淀
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:
、
、
、
B.
的溶液中:
、
、
、
C.能使甲基橙变红的溶液中:
、
、
、
D.
的溶液中:
、
、
、
难度: 简单查看答案及解析
-
乙烯气相直接水合反应制备乙醇:
。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,
,容器体积为1 L)。下列分析不正确的是( )
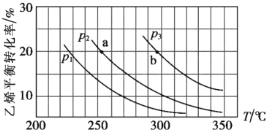
A.图中a点对应的平衡常数
B.图中压强的大小关系为:
C.乙烯气相直接水合反应的
D.达到平衡状态a、b所需要的时间:
难度: 简单查看答案及解析