-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 12 g NaHSO4晶体中,阴阳离子总数为0.3NA
B. 标准状况下,56LHF中含有的电子数为2.5NA
C. 由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA
D. 常温下电解饱和食盐水,当溶液pH值由7变为12时,电路中转移的电子数为0.01NA
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.除去水垢中的CaSO4常用试剂有碳酸钠和盐酸
B.可用碘水检验淀粉是否发生了水解
C.煤干馏可以得到焦炉气、粗氨水、芳香族化合物、焦炭等物质
D.天然纤维有羊毛、蚕丝、棉、麻等,羊毛、蚕丝的主要成分是蛋白质,棉、麻的主要成分是纤维素
难度: 中等查看答案及解析
-
正确掌握化学用语和化学基本要领是学好化学的基础。下列有关表述中正确的一组是( )
A.过氧乙酸(CH3COOOH)与烃基乙酸(HOCH2COOH)所含官能团相同,互为同分异构体
B.16O与18O互为同位素:H216O、D216O、H218O、D218O互为同素异形体
C.SiH4、CH4、P4分子的空间构型为正四面体形;CO2、C2H2均为直线形分子
D.Ca2+的结构示意图为
 ;NH4Cl的电子式为
;NH4Cl的电子式为难度: 中等查看答案及解析
-
甲苯的二氯代物有( )
A.8种 B.9种 C.10种 D.11种
难度: 中等查看答案及解析
-
下列陈述的知识正确的是( )
A.C2H6与C3H8互为同系物,C2H4与C3H6也一定互为同系物
B.一种化合物不是电解质就一定是非电解质
C.离子化合物中可能含有共价键,共价化合物中也可能含有离子键
D.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
难度: 中等查看答案及解析
-
江俊、宋礼教授合作设计的一种“松果结构”铂金属催化剂,可用于电解法制备氢气,在制氢效果不变的情况下,将铂金属的用量降低到传统商业催化剂的约
。下列说法错误的是( )
A.使用催化剂可以增加活化分子的百分数
B.催化剂与反应物接触面积的大小会影响反应速率
C.升高温度能加快反应速率,同样可增加活化分子的百分比
D.催化剂与反应物接触面积的大小会影响反应的焓变
难度: 中等查看答案及解析
-
下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
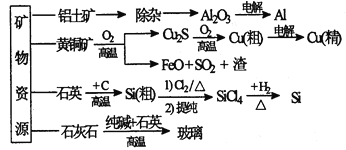
A.粗铜电解精炼时,粗铜作阳极
B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C.黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
难度: 中等查看答案及解析
-
“84”消毒液(有效成分为NaClO)可用于消毒和漂白,对下列实验现象的分析错误的是
实
验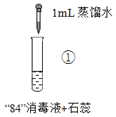
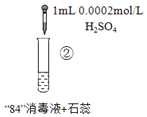

现
象混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。
混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。
混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。
A.实验③中产生的气体是Cl2,由HClO分解得到:2HClO=Cl2↑+H2O
B.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO-+H+=HClO
C.对比实验②和③,溶液的pH可能会影响ClO-的氧化性或Cl-的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控到合适的pH才能安全使用
难度: 中等查看答案及解析
-
微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法错误的是( )
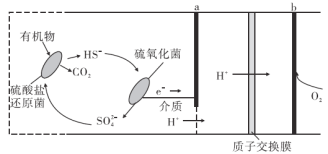
A.HS-在硫氧化菌作用下转化为SO42-的反应为:HS-+4H2O-8e-=SO42-+9H+
B.电子从a流出,经外电路流向b
C.该电池在高温下同样能工作,且反应原理相同
D.若该电池电路中有0.4mol电子发生转移,则有0.4molH+通过质子交换膜
难度: 中等查看答案及解析
-
分类是化学学习和研究的常用手段,下列分类依据和结论错误的有( )
①Na2O2、Fe2O3属于碱性氧化物,CO、NO属于酸性氧化物
②碳酸氢钠、氯化铝、氯化铵都属于离子化合物
③漂白粉、空气、冰水混合物均属于混合物
④醋酸、纯碱和胆矾分别属于酸、碱、盐
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的2mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法错误的是( )
A.发生的反应为氧化还原反应
B.刺激性气味的气体可能是氨气
C.NH4CuSO3中铜元素既被氧化又被还原
D.2molNH4CuSO3完全反应转移1mol电子
难度: 中等查看答案及解析
-
短周期元素
的原子序数依次增大。
是由这些元素组成的二元化合物,常温常压下
为液体,其余均为无色气体。
的摩尔质量为
的2倍,
是元素
的单质,是绿色植物光合作用产生的无色气体,
物质能使湿润的红色石蕊试纸变蓝,
能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是
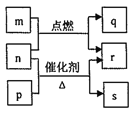
A.
与
均为酸性氧化物 B.
的含氧酸是一种强酸
C. 沸点:
D. 原子半径:
难度: 中等查看答案及解析
-
以硫铁矿(主要成分为
)为原料制备氯化铁晶体(
)的工艺流程如下所示:

下列说法不正确的是
A. “酸溶”过程中使用的酸也可以是硝酸
B. 为防止污染,“焙烧”过程中产生的
应回收利用
C. 通入氯气的目的是氧化
D. 用
制取无水
时,需要在氯化氢气流中加热
难度: 中等查看答案及解析
-
25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
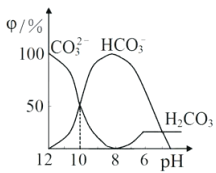
A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
难度: 困难查看答案及解析
-
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为( )
A. 7.84L B. 6.72L C. 4.48L D. 无法计算
难度: 困难查看答案及解析
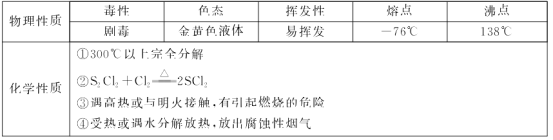
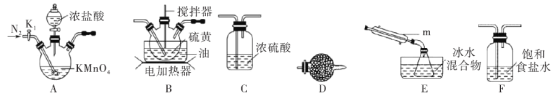
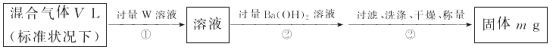
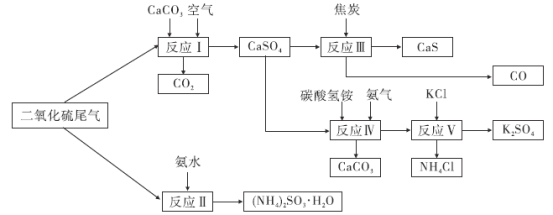

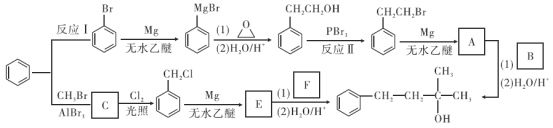
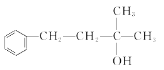 )的合成路线。
)的合成路线。