-
将浓度均为0.1 mol/L的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是
A. BaCl2、NaOH、NaHCO3 B. Na2CO3、MgCl2、H2SO4
C. AlCl3、NH3·H2O、NaOH D. Ba(OH)2、CaCl2、Na2SO4
难度: 简单查看答案及解析
-
下列反应中,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④
C. ③①②④ D. ①②③④
难度: 中等查看答案及解析
-
下列关于Fe(OH)3胶体的说法中,不正确的是 ( )
A. 分散质粒子直径在10-9~10-7m之间 B. 是一种纯净物
C. 具有丁达尔效应 D. 具有净水作用
难度: 简单查看答案及解析
-
下列各离子能大量共存的是( )
A.无色透明的溶液中:Cu2+、K+、SO42-、NO3-
B.使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
C.NH4Cl溶液中:K+、OH-、SO42-、Cl-
D.pH=1的溶液中:Na+、K+、HCO3-、NO3-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
难度: 困难查看答案及解析
-
下列叙述不正确的是
选项
被提纯物质
杂质
除杂试剂或方法
A
FeCl3溶液
FeCl2
通入适量Cl2
B
Cl2
H2O (蒸气)
通入浓硫酸中
C
铜粉
铁粉
加入过量盐酸并过滤
D
CO2
HCl
通入饱和的碳酸钠溶液中
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2FeO4是还原产物
B.Na2O2既是氧化剂又是还原剂
C.若有2molFeSO4参与反应,则该反应中共有8mol电子转移
D.Na2O2与水反应生成NaOH和氧气,所以Na2O2是碱性氧化物
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L−1硫酸钾溶液中阴离子所带电荷数为NA
难度: 中等查看答案及解析
-
为了防止食品受潮及富脂食品氧化变质,在包装袋中应放入的独立包装的物质是( )
A.无水硫酸铜、蔗糖 B.食盐、硫酸亚铁
C.生石灰、还原铁粉 D.生石灰、食盐
难度: 简单查看答案及解析
-
我国的自来水一般是用氯气消毒的。某学生用这种自来水配制下列物质的稀溶液,不会产生明显的药品变质的是
A. AgNO3 B. KI C. NaClO D. FeCl2
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)
Fe2O3+3H2
难度: 中等查看答案及解析
-
下列实验,能达到实验目的的是
A
B
C
D
观察钾元素的焰色
实验室制备Fe(OH)2
制备氧化钠
比较NaHCO3和Na2CO3溶解度


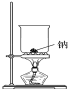
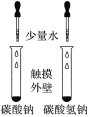
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2 mol·L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。则盐酸的浓度是
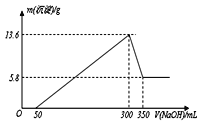
A.2.5mol L-1 B.3mol L-1
C.3.5mol L-1 D.4mol L-1
难度: 中等查看答案及解析
-
下列物质中不能用化合反应的方法生成的是
①Fe3O4 ②H2SiO3 ③Fe(OH)3 ④Cu(OH)2 ⑤FeCl2 ⑥CaSiO3
A.①③④⑥ B.②④ C.②④⑤ D.①②④
难度: 中等查看答案及解析
-
某温度下,将氯气通入氢氧化钠溶液中,反应得到氯化钠、次氯酸钠、氯酸钠的混合液,经测定溶液中次氯酸钠和氯酸钠的浓度之比为1∶2,则氯气与氢氧化钠溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21∶5 B.11∶3
C.3∶1 D.4∶1
难度: 中等查看答案及解析
-
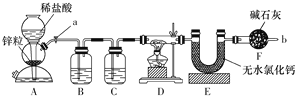
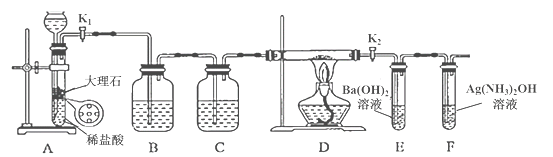
某同学设计如下装置进行铁与水反应的实验,虚线框处的装置用来检验生成的气体。下列说法正确的是(已知:Fe + 2Fe3+ = 3Fe2+)

A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲
C.实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑变红
D.实验后,将装置B中的固体溶于足量稀硫酸,所得溶液中一定含有Fe3+
难度: 中等查看答案及解析