-
化学与生活密切相关,下列说法错误的是
A.碳酸钠可用于去除餐具的油污 B.碳酸钡可用于胃肠X射线造影检查
C.氢氧化铝可用于中和过多胃酸 D.漂白粉可用于生活用水的消毒
难度: 简单查看答案及解析
-
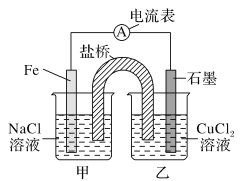
下列说法中不正确的是
A.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
B.配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释到所需的浓度
C.向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D.某些吸热反应不加热也可以自发进行
难度: 简单查看答案及解析
-
下列叙述正确的是
A.吸热反应一定是反应物总能量大于生成物的总能量
B.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
难度: 中等查看答案及解析
-
下列有关电池的说法不正确的是( )
A.太阳能电池的主要材料是高纯度的二氧化硅
B.铜锌原电池工作时,电子沿外电路从锌电极流向铜电极
C.氢氧燃料电池工作时,氢气在负极被氧化
D.原电池中一定发生了氧化还原反应
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
难度: 简单查看答案及解析
-
在体积可变的密闭容器中,反应mA(g)+nB(s)
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是 ( )
A.(m+n)必定小于p B.(m+n)必定大于p
C.m必定小于p D.n必定大于p
难度: 简单查看答案及解析
-
一定温度下,恒容密闭容器中,可逆反应H2(g)+I2(g)
2HI(g)达到化学平衡状态的标志是
A.混合气体的压强不再变化 B.混合气体的颜色不再变化
C.反应速率v(H2)=0.5v (HI) D.c(H2):c(I2):c(HI)=1:1:2
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中不正确的是
A.1mol Na2O 和Na2O2混合物中含有的阳、阴离子总数是3NA
B.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
C.室温下,1L pH=1的H3PO4溶液中,含有0.1NA个H+
D.常温常压下,17 g氢氧根离子中所含的电子数为9NA
难度: 中等查看答案及解析
-
反应H2(g) + I2(g)
2HI(g)的平衡常数K1 ,反应 HI(g)
H2(g)+
I2(g)的平衡常数K2 ,则K1、K2的关系为(平衡常数为同温度下的测定值)
A.K1=2K2 B.K1=K22 C.K1=
D.K1=
K2
难度: 简单查看答案及解析
-
下列水解反应的离子方程式书写正确的是
A.Fe3++3H2O
Fe(OH)3↓+3H+
B.Cl−+H2O
HCl+OH−
C.CO32-+2H2O
H2CO3+2OH−
D.NH4++2H2O
NH3·H2O+H3O+
难度: 简单查看答案及解析
-
水的电离过程为H2O
H++OH−,在不同温度下其离子积为Kw(25℃)=1.0×10−14,Kw(35℃)=2.1×10−14,则下列叙述正确的是
A.c(H+)随着温度的升高而降低
B.在35 ℃ 的纯水中时,c(H+)>c(OH−)
C.水的电离常数Kw(25℃)>Kw(35℃)
D.水的电离是一个吸热过程
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,且X、Z是同族元素,W元素的单质为淡黄色固体。它们的最高价氧化物溶于水可得四种溶液,0.010mol·L-1的这四种溶液pH与该元素原子半径的关系如右图所示。下列说法正确的是

A.W的氧化物的水化物一定是强酸
B.气态氢化物的稳定性:Z>X
C.简单离子半径:W>Y
D.Y与W形成的化合物一定含有共价键
难度: 中等查看答案及解析
-
恒温恒压下,在容积可变的器皿中,反应2NO2 (g)
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.减小 B.增大 C.不变 D.无法判断
难度: 简单查看答案及解析
-
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-的水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(g)
cC(g)+dD(g),反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图。下列叙述不正确的是
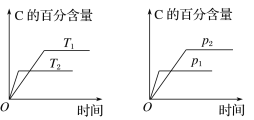
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化剂,则C的百分含量不变
C.化学方程式中a+b>c+d
D.达平衡后,减小A的量有利于平衡向左移动
难度: 简单查看答案及解析
-
已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
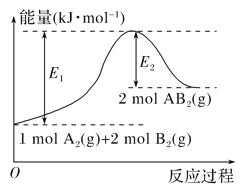
A. 该反应是放热反应
B. 该反应的ΔH=-(E1-E2) kJ· mol-1
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
难度: 中等查看答案及解析
-
以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
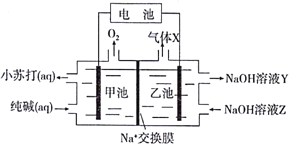
上述装置工作时,下列有关说法正确的是
A. Na+由乙池穿过交换膜进入甲池
B. 甲池电极反应:4CO32-+2H2O-4e-=4HCO3-+O2↑
C. 乙池电极接电池正极,气体X为H2
D. NaOH溶液Y比NaOH溶液Z浓度小
难度: 困难查看答案及解析
-
新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是

A.放电时,负极反应式:Li-e- =Li+
B.应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C.放电时,随外电路中电子的转移,水性电解液中离子总数减少
D.Li+穿过固体电解质向正极移动而得到LiOH溶液
难度: 中等查看答案及解析
-
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
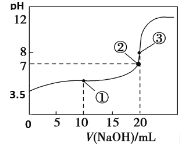
A.常温下,HA电离常数为1.0×10-6
B.点②所示溶液中:c(Na+)< c(HA)+c(A-)
C.点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D.从点①到点③的滴定过程中,水的电离程度不变
难度: 困难查看答案及解析
-
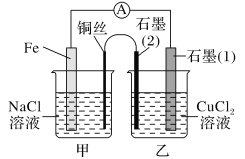
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如右图。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法正确的是

A.无论是否鼓入空气,负极的电极反应式均为Fe-3e-= Fe3+
B.鼓入空气时,每生成1mol·OH有2mol电子发生转移
C.不鼓入空气时,正极的电极反应式为H+ + e- = H·
D.处理含有C2O42-的污水时,上端开口应关闭
难度: 困难查看答案及解析