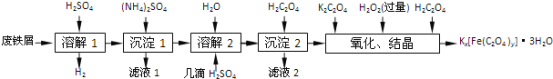
-
常温离子液体(IonicLiquid)也称常温熔融盐。硝酸乙基铵[(C2H5NH3)NO3]是人类发现的第一种常温离子液体,其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
A.硝酸乙基铵含有的化学键与硝酸乙酯完全相同
B.水溶液呈碱性
C.室温条件下,该物质可导电
D.是共价化合物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,N表示粒子数。下列说法正确的是( )
A.0.1mol苯乙烯中含有碳碳双键的数目为0.4NA
B.将0.1molCl2通入到水中,氯气完全被吸收,则N(HClO)+N(Cl-)+N(ClO-)=2[0.1NA—N(Cl2)]
C.1molS在足量氧气充分燃烧,转移电子数为6NA
D.电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g
难度: 中等查看答案及解析
-
利用下列装置进行相应实验,有关说法不正确的是
A.图
 装置可验证酸性:
装置可验证酸性:B.图
 装置可用于收集气体
装置可用于收集气体C.图
 装置可用于分离
装置可用于分离萃取碘水后的有机层和水层
D.图
 装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出难度: 中等查看答案及解析
-
五种短周期主族元素X、Y、Z、W、R。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素与Y元素同主族。下列叙述错误的是( )
A.60gZY2中含有2molZ-Y极性共价键
B.简单氢化物的稳定性:Y>R
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.X与Y形成的两种常见化合物中阴、阳离子的个数比均为1:2
难度: 中等查看答案及解析
-
我国自主研制可治疗H7N9禽流感新药帕拉米韦,结构如图。下列有关说法正确的是( )
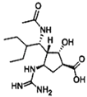
A.该有机物的分子式是C15H27O4N4
B.该分子中含有氨基、羧基、羟基、醛基等官能团
C.该分子具有两性
D.该分子能Na反应,但不能与NaOH溶液反应
难度: 中等查看答案及解析
-
高炉炼铁过程中发生反应:Fe2O3(s)+3CO(g)
2Fe(s)+3CO2(g) ΔH=akJ/mol,该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/°C
1000
1150
1300
平衡常数K
4.0
3.7
3.5
A.a>0
B.当反应达到平衡时,在其他条件不变的情况下,加入少量的Fe2O3,CO的转化率不变
C.为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D.1000°C下Fe2O3与CO反应,tmin达到平衡时c(CO)=2×10-3mol/L,则用CO表示该反应的平均速率为2×10-3/tmol/(L·min)
难度: 中等查看答案及解析
-
我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法不正确的是
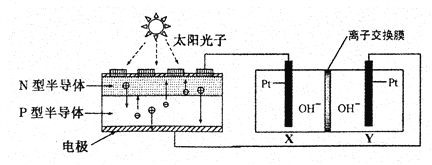
装置a 装置b
附:⊕表示阳离子,Θ表示阴离子
A.装置a将太阳能转化为电能,装置b将电能转化为化学能
B.工作过程中OH-向Y电极周围移动
C.人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
D.反应完毕后恢复到原温度,装置b中电解质溶液的碱性减弱
难度: 困难查看答案及解析