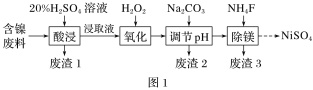
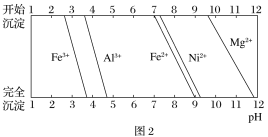
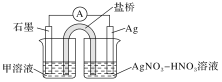
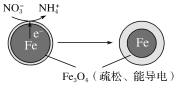
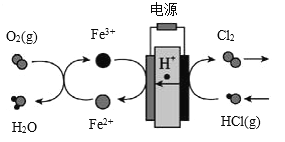
-
用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是( )
A.AgNO3 CuCl2 Cu(NO3)2 B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3 D.HCl HNO3 K2SO4
难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏伽德罗常数)
A.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
B.地下钢铁管道用导线连接锡块可以减缓管道的腐蚀
C.除去MgCl2溶液中的少量FeCl3,加入足量氢氧化钠,充分反应后,过滤
D.1molCl2溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
难度: 中等查看答案及解析
-
电池是人类生产和生活中的重要能量来源,各式各样的电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时氧气在正极被还原
D.太阳能电池的主要材料是高纯度的二氧化硅
难度: 简单查看答案及解析
-
下列说法能用平衡移动原理解释的是
A.在电解水实验中,加入硫酸钠可以提高电解效率
B.碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成
C.在一定温度下某容器内发生下列反应:I2(g)+H2(g)
2HI(g) △H<0,缩小容器的体积,混合气体颜色加深
D.在双氧水中加FeCl3溶液可使产生O2速率加快
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.已知:① C(s石墨)+O2(g)=CO2(g)
H1= —393.5mol/L,②C(s金刚石)+O2(g)=CO2(g)
H2= —395.0mol/L,则金刚石比石墨稳定
B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为-285.8kJ·mol-1
C.一定条件下2SO2(g)+O2(g)
2SO3(g) △H1,2SO2(g)+O2(g)
2SO3(l) △H2则△H1>△H2
D.在一定温度和压强下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为 N2(g)+3H2(g)
2NH3(g) △H=﹣38.6kJ/mol
难度: 中等查看答案及解析
-
下列有关化学反应的表述正确的是
A.电解熔融NaCl:2Cl-+2H2O
2OH-+Cl2↑+H2↑
B.NaHS溶液显碱性:HS-+H2O
H3O++S2-
C.明矾净水:Al3++3H2O=Al(OH)3(胶体)+3H+
D.制备TiO2纳米粉:TiCl4+(x+2)H2O(过量) = TiO2·xH2O↓+4HCl
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是( )
A. 向0.1mol/LNa2CO3溶液中通入适量
气体后:
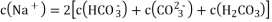
B. pH=6的NaHSO3溶液中:
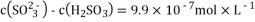
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:
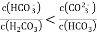
D. 0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2 C2O4为二元弱酸):
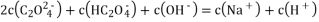
难度: 中等查看答案及解析
-
下列说法正确的是
A.恒温恒压容器中,反应A(s)+2B(g)
2C(g)达平衡后,再通入气体C,再达平衡时气体B的浓度保持不变
B.恒温恒容容器中,通入一定量的N2O4,反应 N2O4 (g)
2NO2 (g)达平衡后,再通入N2O4,平衡正向移动,再达平衡时N2O4的转化率增大
C.恒温下,向密闭容器中加入NH2COONH4固体,发生反应NH2COONH4(s)
2NH3(g)+CO2(g) ,混合气体的平均相对分子质量不再随时间变化时反应达平衡状态
D.恒温恒容容器中,N2(g)+3H2(g)
2NH3(g)达平衡后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大
难度: 困难查看答案及解析
-
如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4溶液为电解质溶液。下列有关说法不正确的是
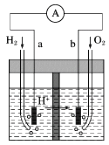
A.a极为负极,电子由a极经外电路流向b极
B.a极的电极反应式:H2-2e-===2H+
C.电池工作一段时间后,装置中c(H2SO4)增大
D.若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
难度: 中等查看答案及解析
-
如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
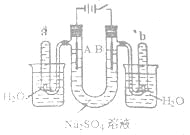
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
难度: 简单查看答案及解析
-
25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
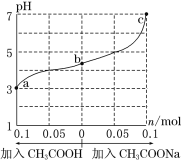
A.b点混合液中c(Na+)>c(CH3COO-)
B.加入CH3COOH过程中,
增大
C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
难度: 困难查看答案及解析
-
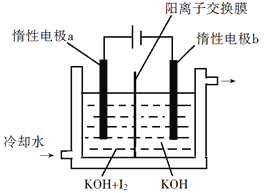
普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜( 阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是
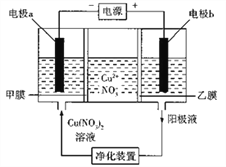
A. 电极a为粗铜,电极b为精铜
B. 甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
C. 乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区
D. 当电路中通过1mol电子时,可生成32g精铜
难度: 困难查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论
A
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液
试管口出现红棕色气体
溶液中NO
被Fe2+还原为NO2
B
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液
先出现白色沉淀后又生成红褐色沉淀
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
C
在滴有酚酞的Na2CO3溶液中,
加入BaC12
溶液红色褪去
CO32-在溶液中存在水解平衡
D
常温下,测定盐酸和醋酸溶液的pH
盐酸pH小于醋酸pH
证明相同条件下,在水中HCl电离程度大于CH3COOH
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是
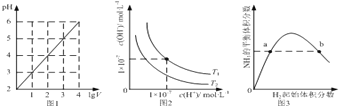

A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B.图2表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中b点N2的转化率小于a点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 中等查看答案及解析