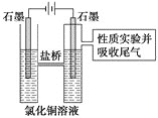
-
对下列物质溶于水时破坏的作用力描述错误的是
A. 氯化钠,破坏了离子键 B. 氯化氢,破坏了共价键
C. 蔗糖,破坏了分子间作用力 D. 二氧化碳,没有破坏作用力
难度: 中等查看答案及解析
-
关于氧化物Na2O2和Na2O的叙述正确的是( )
A. 阴阳离子个数比均为1∶2 B. 都含有非极性的共价键
C. 与水都发生氧化还原反应 D. 都属于碱性氧化物
难度: 中等查看答案及解析
-
下列图象是表示铁加入到一定量硝酸中时,铁和硝酸铁之间物质的量(mol)的关系,其中正确的是
A.
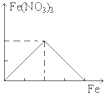 B.
B.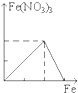 C.
C.D.
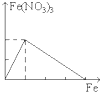
难度: 困难查看答案及解析
-
如图所示装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸,并使a、b两端液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )
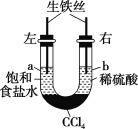
A.铁丝在两处的腐蚀速率:a<b
B.a、b两端相同的电极反应式为Fe-2e-===Fe2+
C.一段时间后,a端液面高于b端液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
难度: 简单查看答案及解析
-
已知:Fe(OH)3的Ksp=2.79×10-39,Al(OH)3的Ksp=1.3×10-31。现将20 mL 0.05 mol/L FeCl3和20 mL 0.05 mol/L AlCl3混合,再向溶液中逐滴加入0.10 mol/L NaOH溶液,测定溶液的pH变化如图所示,则下列说法不正确的是( )
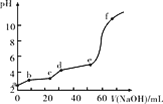
A.a点处,Al3+水解程度比Fe3+水解程度大
B.bc段主要产生Fe(OH)3沉淀
C.de段主要反应:Al3++3OH-=Al(OH)3↓
D.向f点所得溶液中通入足量CO2,沉淀的质量会变大
难度: 中等查看答案及解析
-
山梨酸(CH3—CH=CH—CH=CH—COOH)是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是
A. 可与钠反应 B. 可与碳酸钠溶液反应
C. 可与溴的四氯化碳溶液发生取代反应 D. 可生成高分子化合物
难度: 中等查看答案及解析
-
制备(NH4)2Fe(SO4)2•6H2O的实验中,需对过滤出产品的母液pH<1进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 中等查看答案及解析

 Fe2++SO42—
Fe2++SO42—
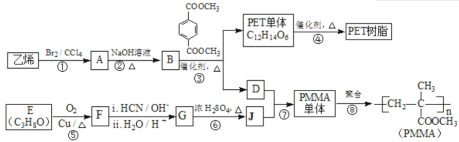
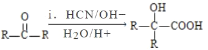 (R、R′代表烃基);
(R、R′代表烃基);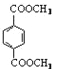 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH