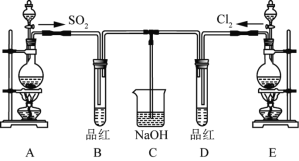
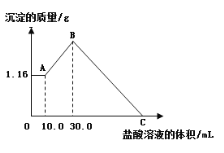
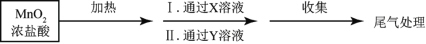-
已知氧化性:Br2>Fe3+>I2;还原性:I->Fe2+>Br-,则下列反应能发生的是
A.I2+2Fe2+===2Fe3++2I- B.2Br-+I2===Br2+2I-
C.2Fe3++2I-===2Fe2++I2 D.2Fe3++2Br-===2Fe2++Br2
难度: 中等查看答案及解析
-
科学家发明的透明坚硬镁铝氧化物新型材料,可以用作显示器和手机屏幕。下列有关镁 和铝的说法正确的是
A.镁的金属性比铝弱
B.镁和铝的氧化物都可以与盐酸反应
C.镁和铝原子的最外层电子数都为3
D.镁和铝的氧化物都可以与氢氧化钠溶液反应
难度: 简单查看答案及解析
-
下列叙述正确的是
A.浓氨水可检验氯气管道漏气
B.将SO2气体通入酸性高锰酸钾溶液中,溶液紫色褪去,证明SO2具有漂白性
C.利用澄清石灰水可以鉴别NaHCO3溶液和Na2CO3溶液
D.向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红,则证明原溶液中一定含有Fe2+
难度: 中等查看答案及解析
-
设NA 表示阿伏加德罗常数,数值约为6.02×1023。下列说法正确的是
A.1 L 0.1mol·L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol
B.0.1 mol水蒸气在标准状况下体积为2.24 L
C.在25℃,1.01×105 Pa时,11.2 L氧气所含的氧原子数目为6.02×1023
D.标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L
难度: 中等查看答案及解析
-
经氯气消毒的自来水,若用于配制以下溶液:①NaOH ②AgNO3③Na2CO3④FeSO4 ⑤ KI ⑥Na2S ⑦Na2SO3,会使配制的溶液变质的是
A.全部 B.②④⑤⑥⑦ C.①②⑤ D.④⑥
难度: 中等查看答案及解析
-
某溶液可能存在Na+、Ba2+、Mg2+、Fe3+、Br-、CO32-、Cl-等离子,某学生进行下列实验:取少量原溶液,测得溶液呈强碱性,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色。关于该原溶液的推测正确的是( )
A.溶液中可能存在Mg2+和Fe3+ B.溶液中可能存在Br-和Cl-
C.溶液可能存在Ba2+和Cl- D.溶液中一定存在Na+和CO32-
难度: 中等查看答案及解析
-
下列关于药品的使用和保存,仪器选用正确的是
A.实验室中保存浓硝酸

B.准确量取9.50 mL稀硫酸
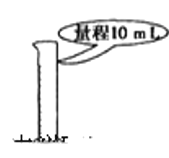
C.实验室中保存Na2CO3溶液

D.用托盘天平称量NaOH固体
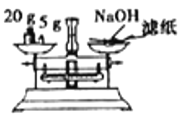
难度: 简单查看答案及解析
-
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
a
b
c
A
Al2O3
AlCl3
Al(OH)3
B
NH3
NO
NO2
C
Si
SiO2
H2SiO3
D
Fe
FeCl2
FeCl3
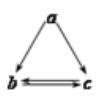
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④强酸性溶液中:Fe2+、Al3+、NO3-、Cl-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
A.② B.②④⑥ C.①②⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
已知反应3Cl2 + 6NaOH=NaCl + NaClO3 + 3H2O下列说法正确的是
A.Cl2既是氧化剂也是还原剂 B.该反应中的电子转移数目为6e-
C.氧化剂和还原剂的质量比是1:5 D.NaCl是氧化产物,NaClO3是还原产物
难度: 中等查看答案及解析
-
下列叙述与胶体的性质无关的是
A.向氢氧化铁胶体中逐滴加入稀盐酸,开始产生红褐色沉淀,后来沉淀逐渐溶解并消失
B.当日光从窗隙射入暗室时,观察到一束光线
C.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘粒子带电荷
难度: 简单查看答案及解析
-
加热条件下把16.8 g铁粉完全溶解于100 mL某浓度的硝酸中,如反应只收集到0.4 mol NO2和0.1 mol NO,下列说法不正确的是
A.反应后溶液中NO3- 的物质的量为0.7 mol
B.硝酸有剩余,铁粉反应完
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶2
D.该硝酸的浓度为12 mol·L-1
难度: 中等查看答案及解析
-
25℃、101KPa时,agNH3与bgCH4的体积相同,下列叙述不正确的是
A.NH3、CH4的物质的量之比为a: b
B.NH3、CH4两种气体的密度之比为a: b
C.NH3、CH4的摩尔质量之比为17: 16
D.NH3、CH4的分子数之比为1 : 1
难度: 中等查看答案及解析
-
如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
难度: 中等查看答案及解析
-
下列有关除杂的实验操作合理的是( )
A.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
B.除去氧气中少量氮气:使气体通过炽热的铜粉
C.除去石英(不溶于水和盐酸)中少量碳酸钙:用稀盐酸溶解后过滤
D.除去氯化钠固体中少量的碳酸钠:加入足量氯化钙,过滤、蒸发、结晶
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A.氯气溶于水中Cl2 +H2O = Cl― + ClO― +2H+
B.金属铁与稀硝酸反应Fe + 2H+ = Fe2+ + H2↑
C.在硅酸钠溶液中滴加稀硫酸 SiO32― + 2H+ = H2SO3↓
D.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析