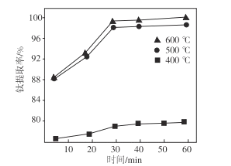
-
化学与生产、生活密切相关,下列说法正确的是( )
A.石油的分馏和煤的液化都是物理变化
B.聚乙烯塑料的老化是因为发生了加成反应
C.被称为“黑金”的新型纳米材料石墨烯属于有机化合物
D.利用化学工艺调整织物孔隙直径,可以制作出防水透气面料
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+
B.滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42-
C.
=1013的溶液:Fe2+、Cl-、MnO4-、SO42-
D.使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2-
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.60gSiO2晶体中含有Si—O键数目为2NA
B.常温常压下,32g16O2中所含的中子数为16NA
C.电解饱和食盐水,阳极上生成22.4L气体时转移的电子数为2NA
D.密闭容器中2molNO与lmolO2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.石灰水中加入过量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.用石墨作电极电解AlCl3溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
C.酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 困难查看答案及解析
-
下列除杂方案合理的是
A.除去溴苯中少量的溴:加入苯萃取,分液
B.除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液
C.除去乙烯中少量的SO2:气体通过盛有酸性高锰酸钾溶液的洗气瓶
D.除去MgCl2溶液中少量的FeCl3:加入稍过量氢氧化钠,过滤
难度: 简单查看答案及解析
-
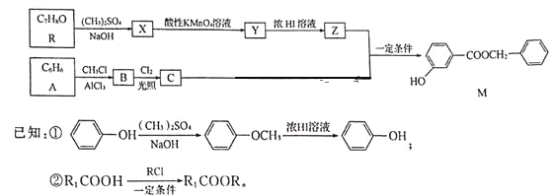
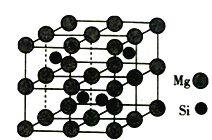
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、6、8、8,它们的最外层电子数之和为10。下列说法正确的是( )
A.X的简单氢化物在同主族元素的氢化物中沸点最高,说明X的非金属性最强
B.工业生产中,通常用电解Z的熔融氧化物来制取Z的单质
C.X和Z形成的原子个数1:1的化合物中,既含有极性键又含有非极性键
D.W与Y可以形成离子化合物
难度: 中等查看答案及解析
-
X、Y、Z、W四种物质的转化关系。下列组合中不符合该关系的是( )
X
Y
Z
W
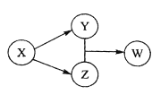
A
Na2CO3
CO2
CaCO3
Ca(HCO3)2
B
SO2
Na2SO3
H2SO4
NaHSO3
C
HCl
FeCl2
Cl2
FeCl3
D
Na2O2
NaOH
Na2CO3
NaHCO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
松油醇具有紫丁香味,其酯类常用于香精调制。如图为松油醇的结构,以下关于它的说法正确的是( )
A.分子式为C10H19O B.能发生取代反应、加成反应
C.属于芳香烃 D.与氢气加成后的产物有4种一氯取代物
难度: 中等查看答案及解析
-
下列根据操作和现象所得出的结论正确的是( )
选项
实验操作及现象
实验结论
A
向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝
H2O2氧化性比I2强
B
向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀
非金属性:S>C>Si
C
向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
原溶液不含NH4+
D
将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸,有气泡产生
Ksp(BaSO4)>Ksp(BaCO3)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
关于下列装置说法正确的是
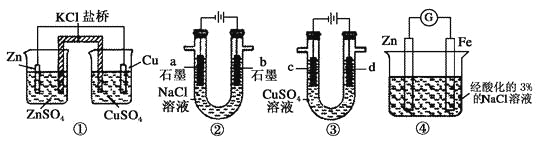
A.装置①中,一段时间后左侧SO42-浓度增大
B.装置②中滴入酚酞,b极附近先变红
C.用装置③精炼铜时,c极为粗铜
D.装置④中在Fe电极附近滴入K3[Fe(CN)6]溶液,可验证Fe电极被保护
难度: 中等查看答案及解析
-
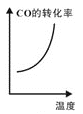
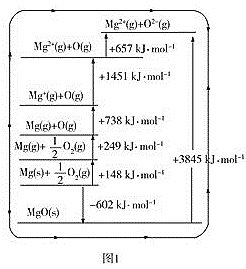
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
难度: 中等查看答案及解析
-
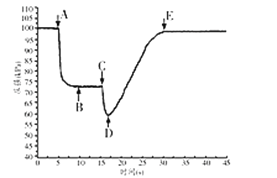
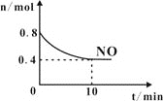
在2L密闭容器中进行反应C(s)+H2O(g)
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A.0~5min内,v (H2)=0.05mol/(L•min)
B.5min时该反应的K值一定小于12 min时的K值
C.10 min时,改变的外界条件可能是减小压强
D.5min时该反应的v (正)大于11 min 时的v (逆)
难度: 中等查看答案及解析
-
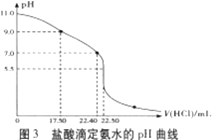
常温下,将0.02mol/LMOH溶液逐滴滴入100mL0.01mol/LHA溶液中,溶液pH随滴入MOH溶液的体积变化如图所示。若忽略溶液混合时的体积变化,下列叙述正确的是( )
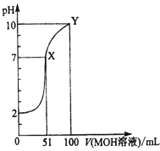
A.温度不变,滴入MOH溶液的过程中水的电离程度不变
B.X点MOH过量,故溶液中c(M+)>c(A-)
C.HA为弱酸,MOH为强碱
D.Y点的c(MOH)+c(M+)=0.01mol/L
难度: 困难查看答案及解析
-
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是( )
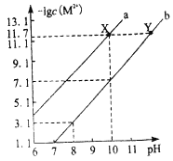
A.曲线b表示Cu(OH)2饱和溶液中的变化关系
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
难度: 困难查看答案及解析
 b.
b. c.
c.