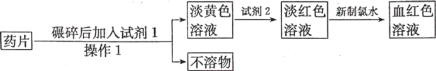
-
化学与生产生活息息相关。下列说法不正确的是
A.城市空气质量报告中,PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
B.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”能提高空气质量
C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D.氧化亚铁可以用作色素,如应用于瓷器制作中使釉呈绿色
难度: 简单查看答案及解析
-
下列物质属于电解质且在该状态下能导电的是
A.Cu B.熔融 NaCl C.KOH 溶液 D.BaSO4 固体
难度: 简单查看答案及解析
-
下列物质属于碱性氧化物的是
A.Na2O B.Na2O2 C.SO2 D.NO2
难度: 简单查看答案及解析
-
美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示,整辆“纳米车”的对角线的长度仅为3至4纳米),每 辆“纳米车”是由一个有机分子和四个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法不正确的是

A.人们用肉眼看不到“纳米车”的运动
B.“纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C.C60是一种新型的化合物
D.C60的摩尔质量为720g•mol-1
难度: 简单查看答案及解析
-
如图表示质量相同的气体X和N2在相同容积的密闭容器中压强(P)和温度(T)的关系,则气体X可能是

A.CO B.NH3 C.CH4 D.CO2
难度: 中等查看答案及解析
-
下列事实中,与胶体有关的是
A.人将植物油倒入水中,用力搅拌形成油水混合物
B.可以用过滤的方法除去粗食盐水中的难溶杂质
C.黑暗的电影院中,放映口发出的光会在影院中形成光柱
D.利用活性炭净水
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是
A.无色溶液中:K+、Cu2+、Na+、SO42-
B.强碱性的溶液中:K+、Na+、Cl-、CO32-
C.强酸性的溶液中:Cl-、Fe2+、NO3-、NH4+
D.使紫色石蕊试液呈红色的溶液中:Fe3+、Ba2+、SCN-、Cl-
难度: 中等查看答案及解析
-
为除去括号内的杂质,所选用的方法正确的是
A.FeCl3溶液(CuCl2),加入Fe粉,过滤
B.CO2(SO2),通入饱和Na2CO3溶液中
C.NO(NO2),通入水中
D.Na2CO3溶液(Na2SO4),加入过量Ba(OH)2溶液,过滤
难度: 中等查看答案及解析
-
下列说法不正确的是
A.2 mol Na2O2与足量水发生反应转移4 mole-
B.少量的金属钠保存在煤油中
C.现代化学已经成为实验与理论并重的科学
D.高炉炼铁中实际起还原作用的是一氧化碳
难度: 中等查看答案及解析
-
下列实验装置正确的是
A.
 加热分解碳酸氢钠
加热分解碳酸氢钠B.
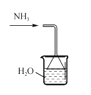 吸收氨气
吸收氨气C.
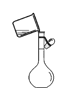 转移溶液
转移溶液D.
 制取氨气
制取氨气难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.小苏打用于治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
B.铜与浓硝酸反应:Cu+3HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=Cu2++2Fe2+
D.向漂白液中通入SO2提高漂白效率:ClO-+SO2+H2O=HClO+HSO3-
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L H2O中含有的原子数目为0.3NA
B.常温常压下,4.6 g NO2与N2O4混合气体中含有的氧原子数目为0.2 NA
C.0.1 mol•L-1 K2CO3溶液中含有的钾离子数目为0.2NA
D.0.lmol铁与足量氯气反应时,转移的电子数目为0.2 NA
难度: 中等查看答案及解析
-
下列关于离子检验的说法中正确的是
A.向某溶液中加入过量BaCl2溶液,产生白色沉淀,再加入过量稀盐酸,沉淀不溶解,则可推断该溶液中一定有SO42-
B.向某溶液中加入稀盐酸,若产生能使澄清石灰水变浑油的气体,则可推断该溶液中一定有CO32-
C.向某溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+
D.向某溶液巾先滴加氯水,再滴加KSCN溶液后显红色,则可推测该溶液中—定含有Fe2+
难度: 中等查看答案及解析