-
下列实验操作和数据记录都正确的是
A.用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
B.用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50 mL
C.用10 mL量筒量取8.25 mL盐酸
D.用pH试纸测得某溶液pH为3.2
难度: 简单查看答案及解析
-
下列关于化学与生产、生活的认识不正确的是( )
A.石油分馏得到的汽油是纯净物
B.使用清洁能源是防止酸雨发生的重要措施之一
C.燃料电池是将化学能直接转化为电能的装置,所以能量利用率高
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
难度: 简单查看答案及解析
-
室温下,有下列四种溶液:①0.1mol·L-1氨水,②0.1mol·L -1 NH4Cl溶液,③0.2mol·L -1 盐酸与0.2mol·L -1 NH4Cl溶液等体积混合,④0.2mol·L -1 NaOH溶液与0.2mol·L -1 氨水等体积混合,四种溶液中c(NH4+ )由大到小排列正确的是( )
A.②③④① B.④①②③ C.①④②③ D.③②①④
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ
B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
难度: 中等查看答案及解析
-
少量铁粉与10mL 0.1mol·L-1的稀盐酸反应反应速率太慢。为了加快此反应速率而不改变H2的产量可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加 CHCOONa固体 ⑤加NaCl溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)改10mL 1mol·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
难度: 简单查看答案及解析
-
室温下,相同浓度和体积的盐酸和醋酸溶液,下列说法正确的( )
A.两者水的电离程度相同
B.与足量的锌反应盐酸产生的氢气多
C.盐酸的c(H+)大于醋酸溶液的c(H+)
D.分别与物质的量浓度相同的NaOH溶液恰好反应完全时,盐酸消耗NaOH溶液的体积多
难度: 简单查看答案及解析
-
进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)3CCH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)2CHCH2CH2CH3
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A.次氯酸的电离方程式:HClO=H++ClO-
B.硫化钠水解的离子方程式:S2-+2H2O
H2S+2OH-
C.电解精炼铜的阴极反应式:Cu-2e-=Cu2+
D.碳酸钙的溶解平衡:CaCO3(s)
Ca2+(aq)+CO32-(aq)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,2.24L CCl4中含有的氯原子数目为0.4mol
B.1mol甲基(-CH3)所含的电子数为9NA
C.16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
D.2L 0.5mol·L-1碳酸钠溶液中CO32-数目为NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN-
B.使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO4-
C.由水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、K+、CO32-、SO42-
D.
=10-12的溶液中:Mg2+、Al3+、NO3-、SO42-
难度: 中等查看答案及解析
-
下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是
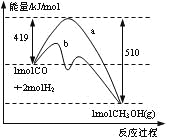
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
难度: 简单查看答案及解析
-
下列说法对应的离子方程式合理的是
A.纯碱溶液去油污:CO32-+H2O==HCO3-+OH-
B.泡沫灭火器工作原理:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
C.铝溶于烧碱溶液:Al+2OH-==AlO2-+H2↑
D.用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2H2O-2e-==PbO2+4H+
难度: 简单查看答案及解析
-
下列有关装置对应实验的说法正确的是下列实验中,所选装置或实验设计合理的是
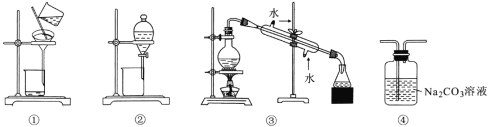
A.用图①所示装置可以除去四氯化碳中混有的溴单质
B.用图②所示装置可以分离乙酸乙酯和饱和碳酸钠的混合溶液
C.用图③所示装置可以分离苯和甲苯的混合溶液
D.用图④所示装置可除去CO2中混有的少量HCl
难度: 简单查看答案及解析
-
反应COCl2(g)
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++ OH-;ΔH > 0 ,下列叙述正确的是
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
探究浓度对反应速率的影响
分别向2支盛有等体积、等浓度的FeCl3和CuCl2溶液的试管中同时加入2 mL5%H2O2溶液
B
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C
探究温度对化学平衡的影响
将盛有NO2和N2O4平衡混合气体(常温下)的玻璃球浸于热水中,观察颜色的变化
D
比较金属的活泼性
向两只盛有稀硫酸的烧杯中分别投入铜丝和银丝
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,将1.0 mol·L-1的氨水滴入10 mL1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A.KW的比较:a点>b点
B.水的电离程度:a>b>c>d
C.b点时溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c点时溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
减小
B.CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中
增大
D.向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中
不变
难度: 中等查看答案及解析
-
我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
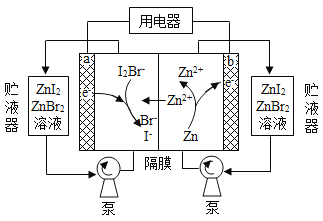
A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重
,溶液中有
被氧化
D. 充电时,a电极接外电源负极
难度: 中等查看答案及解析
-
下列有机物实际存在且命名正确的是
A.2,2-二甲基丁烷 B.2-甲基-5-乙基己烷
C.3-甲基-2-丁烯 D.3,3-二甲基-2-戊烯
难度: 简单查看答案及解析
-
下列有关除杂质(括号中为杂质)的试剂及操作中,不正确的是
A.乙烷(乙烯):溴水,洗气 B.乙醇(水):蒸馏
C.乙酸乙酯(乙酸):饱和碳酸钠溶液,分液 D.溴苯(溴):氢氧化钠溶液,分液
难度: 中等查看答案及解析
-
某有机物A用质谱仪测定如图1,核磁共振氢谱图如图2,则A的结构简式可能为

A.CH3OCH3 B.CH3CHO C.HCOOH D.CH3CH2OH
难度: 中等查看答案及解析
-
某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是( )
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:8
C.无法确定该化合物是否含有氧元素
D.该化合物中一定含有氧元素
难度: 简单查看答案及解析
 ⑤CH3CHO ⑥
⑤CH3CHO ⑥