-
化学与生产、生活密切联系.下列有关说法正确的是( )
A.目前研究菠菜蛋白质“发电”不属于“太阳能文明”
B.二氧化硫有毒,禁止用作葡萄酒添加剂
C.燃料电池是利用燃料在电池中燃烧实现热能转化为电能
D.太阳能电池可将太阳能直接转化为电能
难度: 中等查看答案及解析
-
雪是冬之精灵,在雪
水
冰的转化中能量变化的叙述正确的是( )
A.ΔH1>0,ΔH2>0 B.ΔH1>0,ΔH2<0
C.ΔH1<0,ΔH2<0 D.ΔH1<0,ΔH2>0
难度: 中等查看答案及解析
-
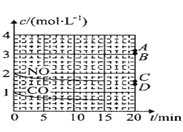
已知反应:2NO(g)+Br2(g)
2NOBr(g) △H=-a kJ·mol-1(a>0),其反应机理是
① NO(g)+Br2 (g)
NOBr2 (g) 快 ② NOBr2(g)+NO(g)
2NOBr(g) 慢
下列有关该反应的说法正确的是
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.增大Br2 (g)的浓度能增大活化分子百分数,加快反应速率
D.总反应中生成物的总键能比反应物的总键能大a kJ·mol-1
难度: 中等查看答案及解析
-
一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g)⇌pC(g)+qD(g),当 m、n、p、q 为任意正整数时,下列状态:
①体系的压强不再发生变化
②体系的密度不再发生变化
③各组分的物质的量浓度不再改变
④各组分的质量分数不再改变
⑤反应速率 vB∶vC∶vD=n∶p∶q
其中,能说明反应已达到平衡的是( )
A.只有③④ B.只有②③④ C.只有①②③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列有机物命名正确的是
A.
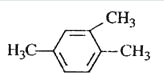 1,3,4-三甲苯
1,3,4-三甲苯B.
 2-甲基-2-氯丙烷
2-甲基-2-氯丙烷C.
 2-甲基-1-丙醇
2-甲基-1-丙醇D.
 2-甲基-3-丁炔
2-甲基-3-丁炔难度: 中等查看答案及解析
-
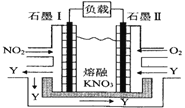
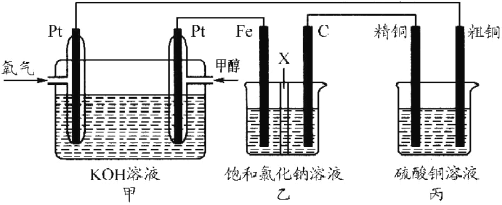
关于下列装置说法正确的是
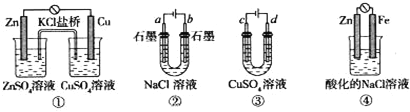
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.滴有酚酞溶液的装置②在电解过程中,b极先变红
C.可以用装置③在铁上镀铜,d极为铜
D.装置④中发生铁的吸氧腐蚀
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是
选项
操作
现象
解释或结论
A
测定等浓度的Na2CO3和Na2SO3溶液的pH
Na2CO3溶液的pH较大
酸性:H2CO3<H2SO3
B
向盛有2ml0.1mol/L AgNO3溶液的试管中滴加几滴 0.1mol/L NaCl 溶液,再向其中滴加一定量0.1mol/L KI溶液
先有白色沉淀生成,后又产生黄色沉淀
Ksp(AgCl)> Ksp(AgI)
C
室温下,取相同大小、形状和质量的Cu粒分别投入0.1mol/L的稀硝酸和10.0mol/L的浓硝酸中
Cu 粒与浓硝酸反应比与稀硝酸反应剧烈
探究浓度对化学反应速率的影响
D
用石墨做电极电Mg(NO3)2、Cu(NO3)2 的混合溶液
阴极上先析出铜
金属活动性:Mg>Cu
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
对于可逆反应 N2(g)+3H2(g)⇌2NH3(g) △H<0,下列研究目的和图示相符的是
A.
 压强对反应的影响(p2>p1)
压强对反应的影响(p2>p1)B.
 温度对反应的影响
温度对反应的影响C.
 平衡体系增加 N2对反应的影响
平衡体系增加 N2对反应的影响D.
 催化剂对反应的影响
催化剂对反应的影响难度: 中等查看答案及解析
-
下列说法正确的是( )
A.
的一溴代物和
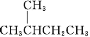 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)B.CH3CH=CHCH3 分子中的四个碳原子在同一直线上
C.按系统命名法,化合物
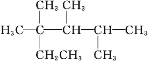 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷D.C6H14的同分异构体有4种
难度: 中等查看答案及解析
-
下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=
③将0.1mol·L-1的NaHS和0.1mol·L-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A.①④ B.②③ C.③④ D.①②
难度: 困难查看答案及解析
-
某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
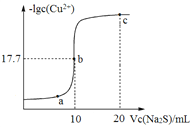
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(H+)+c(HS-)+c(H2S)= c(OH-)
C.该温度下Ksp(CuS)=4×10-36 mol2/L2
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol•L-1的混合溶液中逐滴加入10-4 mol•L-1的Na2S溶液,Zn2+先沉淀
难度: 中等查看答案及解析
-
将 AgNO3 、Ba(NO3)2 、Na2SO4 、NaCl 四种电解质按物质的量之比1∶1∶1∶2加入足量蒸馏水中,然后用铂电极电解该混合物至不再有溶质离子参与反应时,则所得氧化产物与还原产物的质量比为
A.71∶2 B.35.5∶108 C.108∶35.5 D.71∶109
难度: 中等查看答案及解析
-
氨分子中氢原子被氨基(﹣NH2)取代后的生成物叫肼(
 ),肼分子中氢原子被烃基取代后的产物叫肼的衍生物,分子式为C2H8N2的同分异构体中属于肼的衍生物共有( )
),肼分子中氢原子被烃基取代后的产物叫肼的衍生物,分子式为C2H8N2的同分异构体中属于肼的衍生物共有( )A.2种 B.3种 C.4种 D.5种
难度: 简单查看答案及解析
-
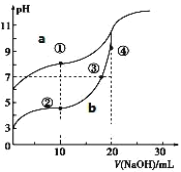
常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是( )

A. a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
C. c点所示的溶液中c(Na+)=c(HClO)+c(ClO-)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
难度: 困难查看答案及解析

 B.
B.