-
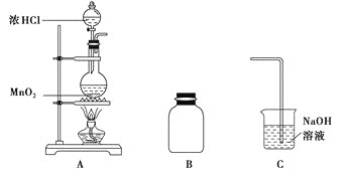
大约4 000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。在古罗马著名诗人荷马的著作里讲到硫燃烧有消毒和漂白作用。下列物质都具有漂白性:①潮湿的氯气、②二氧化硫、③活性炭、④过氧化钠,其漂白原理相同的是( )
A. ①③ B. ②③ C. ①④ D. ②④
难度: 中等查看答案及解析
-
标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是()
A. 标准状况下,同体积的气体A和气体B的质量比为m:n
B. 25℃时,1kg气体A和1kg气体B的分子数之比为n:m
C. 同温同压下,气体A与气体B的密度之比为m:n
D. 标准状况下,等质量的A和B的体积比为m:n
难度: 简单查看答案及解析
-
下列性质中体现了金属物理通性的是( )
A.铜能导电传热、有延展性 B.铝常温下不溶于浓硝酸
C.铁能够被磁铁磁化 D.钠与水剧烈反应放出氢气
难度: 中等查看答案及解析
-
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是 ( )
A.2 4 3 2 2 6 B.0 2 1 0 1 2
C.2 0 1 2 0 2 D.2 2 2 2 1 4
难度: 中等查看答案及解析
-
下面做法或物质用途的叙述中错误的是( )
A.盐卤可用于制豆腐 B.活性炭作吸附剂
C.以无水酒精作外科消毒剂 D.明矾作净水剂
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-===CO2↑+H2O
B.铁和稀硝酸反应:Fe+2H+===H2↑+Fe2+
C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH﹣===Al(OH)3↓
D.NaHCO3溶液与NaOH溶液反应:OH﹣+ HCO3-=== CO32-+H2O
难度: 中等查看答案及解析
-
在水溶液中,下列电离方程式正确的是
A.Al2(SO4)3=2Al3++3SO42-
B.AlCl3=Al3++Cl3-
C.Mg(NO3)2=Mg+2+2NO3-
D.KMnO4=K++Mn7++4O2-
难度: 中等查看答案及解析
-
用等质量的金属钠进行下列实验,产生氢气最多的是( )
A.将钠放入足量的稀盐酸中
B.将钠放入足量的稀硫酸中
C.将钠放入足量的硫酸氢钠溶液中
D.将钠用铝箔包好,并刺穿一些小孔,放入足量的水中
难度: 中等查看答案及解析
-
下列有关电解质的说法中正确的是( )
A.氢氧化钠固体溶于水后能导电,所以氢氧化钠是电解质
B.二氧化碳水溶液能够导电,所以二氧化碳是电解质
C.铁、铜能导电,所以铁、铜为电解质
D.氯化铁溶液能够导电,所以氯化铁溶液是电解质
难度: 中等查看答案及解析
-
同温同压下,下列气体的密度最大的是( )
A.F2 B.Cl2 C.HCl D.CO2
难度: 简单查看答案及解析
-
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O;
②2A2++B2=2A3++2B﹣;
③2B-+Z2=B2+2Z-。
由此推断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z﹣可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.Z2可以置换出X2+溶液中的X
D.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
难度: 中等查看答案及解析
-
下列有关硅及其化合物的说法正确的是( )
A.晶体硅具有金属光泽、能导电,属于金属材料
B.硅的化学性质比较稳定,在自然界中主要以游离态存在
C.二氧化硅是一种酸性氧化物,能够与水反应生成相应的酸
D.加入适量的稀盐酸可以除去二氧化硅中混有的碳酸钙
难度: 简单查看答案及解析
-
下列关于氧化还原反应的叙述,正确的是
A.有一种元素被氧化,肯定有另一种元素被还原
B.在反应中不一定所有元素的化合价都发生变化
C.某元素由化合态变为游离态,则该元素一定被还原
D.氧化还原反应中一定有电子的得与失
难度: 中等查看答案及解析
-
相同状况下,在容积相同的三个烧瓶内分别充满干燥的NH3、HCl、NO2气体,然后按上述顺序分别用水做喷泉实验。实验结束后,烧瓶内三种溶液的物质的量浓度之比为
A.3∶3∶2 B.2∶2∶3 C.1∶1∶1 D.无法比较
难度: 简单查看答案及解析
-
一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如右图所示。
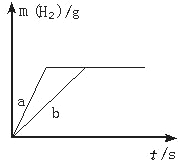
则下列说法正确的是
A. 投入的Na、K一定等质量.
B. 投入的Na的质量小于K的质量
C. 曲线a为Na,b为K
D. 稀盐酸的量一定是不足量的
难度: 中等查看答案及解析
-
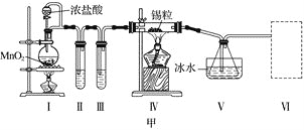
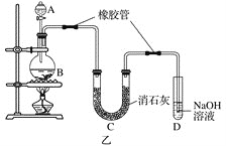
下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )
A.可利用如图所示装置,制备氢氧化亚铁
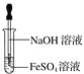
B.氢氧化亚铁为灰绿色絮状沉淀
C.氢氧化亚铁易被空气氧化
D.实验制备中,氢氧化钠溶液应预先煮沸
难度: 中等查看答案及解析
-
铝硅合金(Si的质量分数为13.5%)在凝固时收缩率很小,因而这种合金适合铸造。有下列三种晶体:①铝,②硅,③铝硅合金,它们的熔点由低到高的顺序是( )
A.①③② B.③①② C.③②① D.②①③
难度: 简单查看答案及解析
-
在8NH3 +3Cl2=N2+6NH4Cl反应中,被氧化的原子与被还原的原子物质的量之比为
A.8︰3 B.1︰3 C.3︰8 D.3︰1
难度: 中等查看答案及解析
-
将硫磺在氧气中燃烧生成气体A,把气体A溶于水得溶液B,向B中滴加溴水,溴水褪色而B变为C;在C中加入Na2S产生气体D,若将D通入B溶液,可得沉淀E;A、B、C、D、E中均含有硫元素。在下列各组中按A、B、C、D、E排列的是( )
A. SO2、H2SO4、H2SO3、H2S、S B. SO2、H2SO3、H2SO4、SO2、SO3
C. SO2、H2SO4、H2SO3、SO2、S D. SO2、H2SO3、H2SO4、H2S、S
难度: 简单查看答案及解析
-
下列关于硅与氢氧化钠溶液反应(Si+2NaOH+H2O=Na2SiO3+2H2↑)的说法正确的是( )
A.氧化剂是NaOH和H2O B.氧化剂是H2O
C.氧化剂是Si D.还原剂是H2O
难度: 中等查看答案及解析
-
下列有关实验的操作不正确的是( )
A.分液时,分液漏斗内的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和氯化钠两种固体
C.过滤氢氧化钠溶液除去不溶性杂质时,需用玻璃棒引流
D.某溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀,该溶液中含有氯离子
难度: 简单查看答案及解析
-
工业纯碱中常含有少量的NaCl杂质,某化学兴趣小组取ag工业纯碱样品与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体。则该样品中纯碱的质量分数是( )
A.
×100% B.
×100%
C.
×100% D.
×100%
难度: 中等查看答案及解析
-
下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)
5KCl+KClO3+3H2O
难度: 中等查看答案及解析
-
单质硅的晶体结构如图所示。
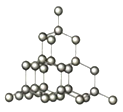
下列关于单质硅晶体的说法不正确的是( )
A.是一种立体网状结构的晶体
B.晶体中每个硅原子与4个硅原子相连
C.晶体中最小环上的原子数目为8
D.晶体中最小环上的原子数目为6
难度: 简单查看答案及解析
-
某溶液中只含有
、
、
、
四种离子,已知前三种离子的个数比为
,则溶液中
和
的离子个数比为
A.
B.
C.
D.
难度: 中等查看答案及解析