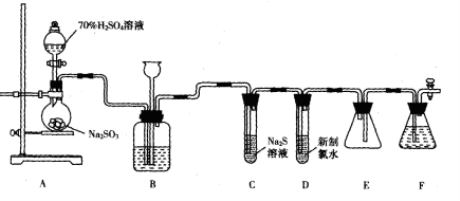
-
化学与生产、生活息息相关,下列叙述错误的是
A.用活性炭去除冰箱中的异味
B.制饭勺、饭盒、高压锅的不锈钢是合金
C.工业生产玻璃、水泥和陶瓷,均需用石灰石作原料
D.人类超量排放氮氧化物和二氧化硫是形成酸雨的主要原因
难度: 中等查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.明矾作净水剂 B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
难度: 中等查看答案及解析
-
下列与化学概念有关的说法正确的是
A.氢、氧两种元素只能组成水
B.不能跟酸反应的氧化物一定能跟碱反应
C.化合反应不一定是氧化还原反应
D.根据是否产生丁达尔效应,将分散系分为溶液、浊液和胶体
难度: 中等查看答案及解析
-
下列实验操作或事故处理方法错误的是
A.少量的金属钠应保存在煤油中
B.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
C.将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌
D.大量氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向低处跑
难度: 中等查看答案及解析
-
常温下,在水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、CO32- B.Fe2+、H+、SO42-、ClO-
C.Mg2+、Cu2+、Cl-、SO42- D.K+、NH4+ 、NO3-、OH-
难度: 中等查看答案及解析
-
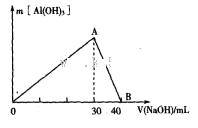
设阿伏加德罗常数的数值为,下列叙述正确的是
A.标准状况下,22.4L四氯化碳含有的分子数为
B.1 mol硫酸钾中阴离子所带的电荷数为2
C.0.5 mol
NaOH溶液中 Na+数为0.5
D.常温常压下,16g氧气所含电子数为
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Cl2通入水中:

B.NaHCO3溶液中滴加盐酸:

C.钠加入水中:

D.铜片放入HNO3稀溶液中:

难度: 中等查看答案及解析
-
下列有关氯及其化合物的叙述错误的是
A.“84”消毒液的有效成分是NaClO
B.AlCl3、FeCl2、CuCl2 均可通过化合反应制得
C.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
利用实验器材(规格和数量不限),能完成相应实验的一项是
实验器材(省略夹持装置)
相应实验
A
烧杯、玻璃棒、蒸发皿
硫酸铜溶液的浓缩结晶
B
三脚架、泥三角、玻璃棒、坩埚
煅烧石灰石制取生石灰
C
烧杯、玻璃棒、胶头滴管、分液漏斗
用溴水和CCl4除去NaBr溶液中的少量NaI
D
酒精灯、烧杯、导管、集气瓶
用KClO3固体和MnO2固体制备并收集O2
难度: 中等查看答案及解析
-
下列物质在给定条件下可以直接转化的是

难度: 中等查看答案及解析
-
下列有关金属及其化合物的说法正确的是
A.Na久置于空气中最终生成NaHCO3
B.Mg比Al活泼,更易与NaOH溶液反应生成H2
C.水蒸气通过灼热的铁粉有红棕色固体生成
D.铜粉与稀硫酸不反应,加入一定量硝酸钠后铜粉溶解
难度: 中等查看答案及解析
-
下列陈述I、Ⅱ正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
浓硝酸的挥发性
浓硝酸应保存在棕色瓶中
B
氧化铝的熔点很高
氧化铝用来制造耐火坩埚
C
氯气具有强氧化性
氯气可用作漂白剂
D
NH4Cl溶液和氨水均能导电
NH4Cl和氨水均是电解质
难度: 中等查看答案及解析
-
C、N、S都是重要的非金属元素。下列说法正确的是
A.三者对应的氧化物均为酸性氧化物
B.加热条件下,浓硝酸可与碳、硫单质发生反应
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.CO2、NO2、SO2都能与H2O反应,其反应原理相同
难度: 中等查看答案及解析
-
等物质的量的下列物质与足量稀硝酸反应,放出NO气体的物质的量最多的是
A.Fe B.FeO C.Fe(OH)3 D.FeSO4
难度: 中等查看答案及解析
-
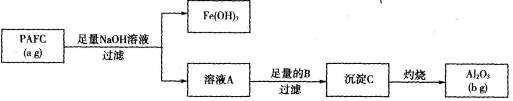
新型纳米材料MFe2O,(3<x <4)中M表示十2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程为:

下列判断正确的是
A.MFe2Ox是还原剂 B.SO2被氧化
C.x>y D.氧化性:MFe2Oy>SO2
难度: 中等查看答案及解析
-
拟用下图装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的的是
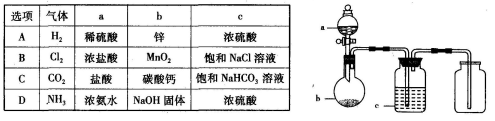
难度: 中等查看答案及解析