-
25℃时,相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4;④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④ C.③>②>①>④ D.④>①>②>③
难度: 中等查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与NaCO3反应生成CO2
D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
下列电离方程式中正确的是
A.NaHSO4溶于水:NaHSO4
Na++H++SO
B.次氯酸电离:HclO === ClO-+H+
C.HF溶于水:HF+H2O
H3O++F-
D.NH4Cl溶于水:NH+H2O
NH3·H2O+H+
难度: 简单查看答案及解析
-
有关下图所示原电池的叙述不正确的是
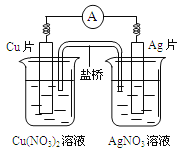
A.电子沿导线由Cu片流向Ag片
B.正极的电极反应是Ag++e-=Ag
C.Cu片上发生氧化反应,Ag片上发生还原反应
D.反应时盐桥中的阳离子移向Cu(NO3)2溶液
难度: 简单查看答案及解析
-
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,若它们的pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的排列顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
难度: 简单查看答案及解析
-
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置
部分实验现象
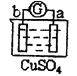
a极质量减小,b极质量增加
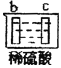
b极有气体产生,c极无变化
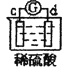
d极溶解,c极有气体产生
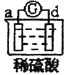
电流计指示在导线中电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
难度: 中等查看答案及解析
-
往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32−(aq)+CaSO4(s)
CaCO3(s)+SO42−(aq)
难度: 中等查看答案及解析
-
下列物质的类别与所含官能团都正确的是( )
A.
酚 —OH
B.
羧酸 —COOH
C.
醛—CHO
D.CH3—O—CH3 酮
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2+ 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e—+ OH-=" NiOOH" + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
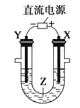
A.氯碱工业中,X电极上反应式是4OH--4e-=2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
难度: 中等查看答案及解析
-
炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
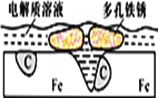
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
难度: 中等查看答案及解析
-
下列有机化合物的链状同分异构体数目最多的是( )
A.丁烷 B.丁烯(C4H8) C.丁醇 D.二氯丁烷
难度: 中等查看答案及解析
-
25 ℃时,有下列四种溶液:
①
②
③
④
0.1 mol·L-1氨水
pH=11氨水
0.1 mol·L-1盐酸
pH=3盐酸
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,c(NH3·H2O)/c(NH4+)的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
难度: 中等查看答案及解析
-
某研究小组为测定食用白醋中醋酸的含量进行如下操作,正确的是( )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4.0 g NaOH放到1 000 mL容量瓶中,加水至刻度,配成1.00 mol·L-1NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
难度: 中等查看答案及解析
-
采用电化学法还原CO2是一种使CO2资源化的方法。下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。下列说法中正确的是
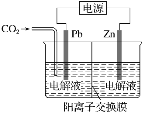
A. Zn与电源的负极相连
B. ZnC2O4在交换膜右侧生成
C. 电解的总反应为2CO2+Zn
ZnC2O4
D. 通入11.2 L CO2时,转移0.5 mol电子
难度: 中等查看答案及解析
-
合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是
A.金属焊接时可用NH4Cl溶液作除锈剂
B.配制FeSO4溶液时,加入一定量Fe粉
C.长期施用铵态氮肥会使土壤酸化
D.向FeCl3溶液中加入CaCO3粉末后有气泡产生
难度: 中等查看答案及解析
-
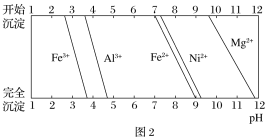
下表是Fe2+、Fe3+、Zn2+被OH-完全沉淀时溶液的pH。某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的ZnSO4,应加入的试剂是
金属离子
Fe2+
Fe3+
Zn2+
完全沉淀时的pH
7.7
4.5
6.5
A. H2O2、ZnO B. 氨水 C. KMnO4、ZnCO3 D. NaOH溶液
难度: 中等查看答案及解析
-
近期媒体曝光了某品牌的洗发水中含有致癌的成分——二恶烷,其结构简式为
。下列有关二恶烷的说法正确的是( )
A.二恶烷的分子式为C6H12O2
B.二恶烷在一定条件下能燃烧生成CO2和H2O
C.二恶烷分子中含有羟基
D.二恶烷中所有原子在同一平面内
难度: 中等查看答案及解析
-
如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4溶液为电解质溶液。下列有关说法不正确的是
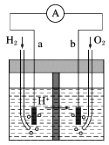
A.a极为负极,电子由a极经外电路流向b极
B.a极的电极反应式:H2-2e-===2H+
C.电池工作一段时间后,装置中c(H2SO4)增大
D.若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
难度: 中等查看答案及解析
-
下列关于盐类水解的说法错误的是( )
A.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③
B.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
难度: 中等查看答案及解析
-
下列与金属腐蚀有关的说法,正确的是

A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
难度: 简单查看答案及解析
-
298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是
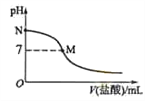
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
难度: 中等查看答案及解析