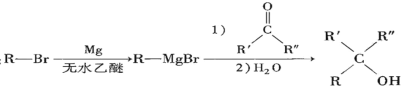-
化学在生产、生活中有广泛的应用。下列说法错误的是
A.硫酸铁可用于补血,是一些补血药剂的主要成份。
B.氯化铁溶液用于止血,与胶体的性质有关。
C.用高铁酸钾代替氯气给自来水消毒,能提高效率并减少二次污染。
D.氧化铁俗称铁红,常用作红色油漆和涂料。
难度: 简单查看答案及解析
-
下列说法正确的是
A.工业上将氯气通入澄清石灰水制取漂白液。
B.油脂和氨基酸在一定条件下均可以与氢氧化钠溶液反应
C.向鸡蛋清水溶液中滴加硫酸铵溶液可使蛋白质发生变性
D.胶体与溶液的本质区别是胶体具有丁达尔效应
难度: 中等查看答案及解析
-
下列有关化学用语的表示错误的是
A.碳化钙的电子式为:
B.明矾的化学式可表示为:K2SO4·Al2(SO4)3·24H2O
C.含有10个中子的氧原子:18O
D.乙烯的结构简式为:C2H4
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含2.8g硅的二氧化硅晶体中存在的共价键总数为0.2NA
B.标准状况下,22.4L NO与11.2L O2混合后所含分子数为1 NA
C.常温常压下,2g氦气中含有的质子数和电子数均为1NA
D.室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为0.01 NA
难度: 中等查看答案及解析
-
下列有关实验目的和装置设计合理的是
选项
A
B
C
D
实验装置
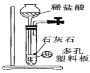
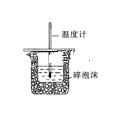
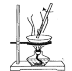
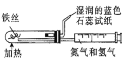
实验目的
实验室制备少量CO2
中和热的测定
蒸干FeSO4溶液制备 FeSO4晶体
模拟工业合成氨并检验产物
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图所示为NaCl固体的溶解过程, 下列有关说法正确的是
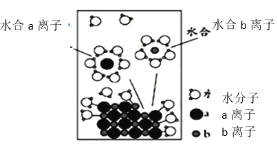
A.a离子为Na+ ,b离子为Cl—
B.氯化钠的电离过程中,断裂离子键时会放出热量
C.水合b离子的图示不科学
D.室温下测得该溶液的pH小于7,是Cl-水解导致的
难度: 简单查看答案及解析
-
下列有关实验的叙述正确的是
选项
实验操作与现象
目的与结论
A
向硅酸钠溶液中滴入稀盐酸,溶液变浑浊
氯的非金属性强于硅,故盐酸能制取硅酸
B
过量的NH3与Cl2混合,产生白烟
NH3与Cl2发生化合反应生成NH4Cl
C
向淀粉水解液中滴加KI溶液,溶液不变色
淀粉完全水解
D
向碘水中加入适量CHCl3,振荡、静置。
下层液体呈紫红色,上层液体颜色变浅
碘在CHCl3中的溶解度大于在水中的溶解度,且CHCl3的密度比水大
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,且互不同族,它们最外层电子数之和为18.其中X、Y元素按原子个数比1∶1可形成一种含共价键的离子化合物。下列说法正确的是
A.原子半径大小顺序为:Z > Y > W > X
B.W的氢化物沸点比X的氢化物的沸点低
C.工业上常用电解饱和YZ溶液制备Y单质
D.由W、X、Y三种元素组成的一种盐溶液可用于去油污
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.向碳酸氢钠溶液中加入足量氢氧化钡溶液:HCO3- + Ba2+ + OH- = BaCO3↓+H2O
B.少量二氧化碳通入次氯酸钠溶液中:CO2 + H2O + 2ClO- = 2HClO + CO32-
C.向硫酸铝溶液中加入过量氨水:Al3++ 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
D.向FeI2溶液中通入足量氯气:2Fe2+ + 2I- +2Cl2 = I2 + 2Fe3+ + 4Cl-
难度: 中等查看答案及解析
-
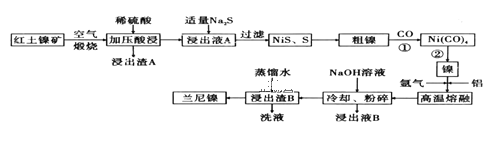
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如图所示:下列说法不正确的是

A.气体A中含有大气污染物SO2
B.由黄铜矿冶炼冰铜的过程中发生了氧化还原反应
C.过量稀硫酸可全部溶解熔渣B
D.电解精炼铜时粗铜应接在电源的正极
难度: 中等查看答案及解析
-
K2Cr2O7溶液中存在平衡Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。已知Cr2O72-有强氧化性,而CrO42-几乎没有氧化性,Cr3+呈绿色。向K2Cr2O7溶液中加入下列物质,下列有关说法不正确的是
A.K2Cr2O7溶液中存在CrO42-
B.加入足量浓盐酸溶液,溶液可变为橙色
C.加入70%的硫酸溶液后再加入C2H5OH,溶液可变为绿色
D.加入30%的NaOH溶液后,溶液可变为黄色
难度: 简单查看答案及解析
-
实验测得0.5 mol·L−1CH3COONa溶液、0.5 mol·L−1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH−)
B. 随温度升高,CH3COONa溶液的c(OH−)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO−、Cu2+水解平衡移动方向不同
难度: 简单查看答案及解析
-
常温下,已知电离常数Kb(NH3·H2O)=1.8×10-5; Ka1(H2C2O4)=5.9×10-2, Ka2(H2C2O4)=6.4×10-5。下列说法正确的是
A.NH4HC2O4溶液中,c(NH4+)= c(HC2O4-)
B.用H2C2O4溶液中和氨水至中性时,溶液中c(NH4+)=c(HC2O4-)+2c(C2O42-)
C.(NH4)2 C2O4溶液呈酸性,属于酸式盐
D.等物质的量浓度的氨水和H2C2O4溶液等体积混合,所得溶液呈碱性。
难度: 中等查看答案及解析
-
[n]-轴烯含有n个以中心碳环为轴心延伸出去的碳碳双键,故称轴烯。[3]-轴烯的结构简式如图所示。下列说法不正确的是

A.[3]-轴烯与甲苯互为同系物
B.[3]-轴烯能发生加成、氧化反应
C.[3]-轴烯与足量H2反应所得产物的二氯代物有5种
D.[3]-轴烯分子中所有原子可能共平面
难度: 中等查看答案及解析
-
新型可控电池――锂水电池的工作原理如图所示。下列说法正确的是
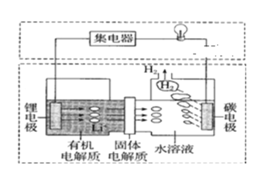
A.有机电解质中可加入乙醇
B.该电池工作时,阳离子向锂电极移动
C.该电池为二次电池。
D.碳电极上发生的反应是2H2O + 2e- = H2↑ + 2OH-
难度: 中等查看答案及解析
-
已知可逆反应X(g)+2Y(g) ⇌Z(g) △H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是
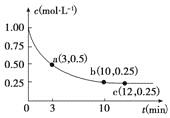
A.a点逆反应速率大于c点正反应速率
B.反应达到平衡时,再加入一定量X,平衡正移,平衡常数K增大
C.该条件下,反应达到平衡时,平衡常数K=3
D.若初始时向该容器中加入1mol X和2mol Y,达到平衡时,X的平衡浓度大于0.125 mol·L-1
难度: 中等查看答案及解析


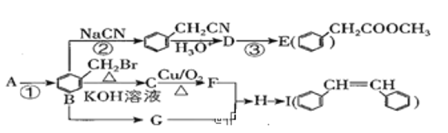
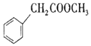 )和具有抗老年痴呆、抗癌、抗氧化、降低血酯等多种重要的生物学功能的I(
)和具有抗老年痴呆、抗癌、抗氧化、降低血酯等多种重要的生物学功能的I(