-
按系统命名法,下列烃的命名正确的是( )
A. 2—甲基—3—戊炔 B. 3—乙基—1—丁烯
C. 2,4,4—三甲基戊烷 D. 2—甲基—3—乙基己烷
难度: 简单查看答案及解析
-
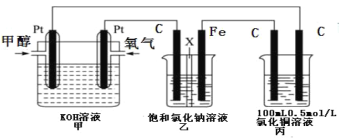
少量铁粉与10mL 0.1mol·L-1的稀盐酸反应反应速率太慢。为了加快此反应速率而不改变H2的产量可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加 CHCOONa固体 ⑤加NaCl溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)改10mL 1mol·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑦⑧
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是
A.铝片和稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.甲烷在氧气中的燃烧
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O(g)=CO(g)△H1;C(s)+
O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H3;S(g)+O2(g)=SO2(g)△H4
③H2(g)+
O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
④CaCO3(s)=CaO(s)+CO2(g)△H7;CaO(s)+H2O(l)=Ca(OH)2(s)△H8
A.① B.④ C.②③④ D.①②③
难度: 中等查看答案及解析
-
关于A(g)+2B(g)=3C(g)的化学反应,下列表示的反应速率最大的是( )
A. v(A)=0.6 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·min-1
C. v(C)=1.2 mol·L-1·min-1 D. v(B)=0.03 mol·L-1·s-1
难度: 简单查看答案及解析
-
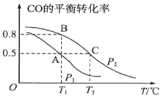
某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
难度: 中等查看答案及解析
-
40 ℃时水的离子积Kw=2.9×10-14,则在40 ℃时,c(H+)=1×10-7mol·L-1的溶液( )
A. 呈酸性 B. 呈碱性 C. 呈中性 D. 无法判断
难度: 简单查看答案及解析
-
下列关于离子共存或化学用语的表述正确的是
A. 由水电离出的c(H+)=1.0×10-12 mol•L−1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常温下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氢钠溶于水的电离方程式为:NaHSO4=Na++H++SO42-
D. 碳酸钠溶液呈碱性的原因:CO32-+2H2O
H2CO3+2OH-
难度: 简单查看答案及解析
-
某同学在实验报告中有以下实验数据,其中数据合理的是( )
A.500 mL容量瓶配制250 mL 0.1mol/L NaCl溶液
B.用量筒量取5.26 mL盐酸
C.用广泛pH试纸测得溶液的pH是3.5
D.用25 mL滴定管量出15.80 mL的NaOH溶液
难度: 简单查看答案及解析
-
下列物质加入水中,因水解而呈碱性的是
A.生石灰 B.熟石灰 C.纯碱 D.烧碱
难度: 简单查看答案及解析
-
下列装置中,能构成原电池的是( )
A.
 B.
B.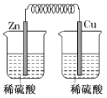 C.
C.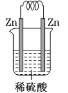 D.
D.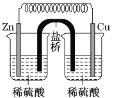
难度: 简单查看答案及解析
-
关于下列各装置图的叙述不正确的是( )
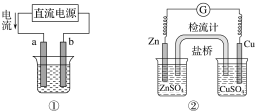

A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
难度: 简单查看答案及解析
-
下列化学用语中正确的是( )
A.羟基的电子式
B.乙烯的结构简式:
C.甲烷的球棍模型:

D.乙醇的分子式:
难度: 中等查看答案及解析
-
下列物质分类正确的是
A.
芳香族化合物
B.
羧酸
C.
 醛
醛D.
酚
难度: 中等查看答案及解析
-
已知:①CO(g)+H2O(g)
CO2(g)+H2(g) △H1
②CH4(g)+H2O(g)
CO(g)+3H2(g) △H2
下列推断正确的是
A.若CO的燃烧热为△H3,则H2的燃烧热为△H3−△H1
B.反应CH4(g)+ CO2(g)
2CO(g)+2H2(g)的△H=△H2−△H1
C.若反应②的反应物总能量低于生成物总能量,则△H2<0
D.若等物质的量CO和H2完全燃烧生成气态产物时前者放热更多,则△H1>0
难度: 中等查看答案及解析
-
在密闭容器中一定量的混合气体发生反应xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A.B的转化率降低 B.平衡向正反应方向移动
C.x+y<z D.C的体积分数增大
难度: 中等查看答案及解析
-
用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A.c(H+)/c(NH4+) B.c(NH3·H2O)/ c(OH-)
C.c(NH4+) c(OH-)/c(NH3·H2O) D.c(H+)c(OH-)
难度: 简单查看答案及解析
-
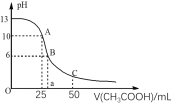
常温下,向20mL0.1mol/LHA溶液中滴加0.1mol/L的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是

A. HA的电离方程式为HA=H++A-
B. B点时加入HA和氨水恰好完全反应
C. A点所示溶液中:c(A-)=2c(NH4+)+2c(NH3·H2O)
D. C点所示溶液中:c(NH4+)>c(A-)>c(NH3·H2O)
难度: 中等查看答案及解析
-
一定条件下化学反应:CO2(g)+H2(g)
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等 B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率 D. 升高温度,平衡逆向移动
难度: 中等查看答案及解析
-
化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s)
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=
难度: 简单查看答案及解析
-
某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
难度: 中等查看答案及解析
-
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC的工作原理如图如示。下列有关说法正确的是( )

A.当有0.1 mol电子转移时,a电极产生2.24 L H2(标况)
B.b电极上发生的电极反应式为4H2O+4e-=2H2↑+4OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应式为O2+4H++4e-=2H2O
难度: 中等查看答案及解析
-
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是( )
A.
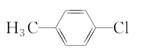
B.
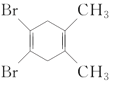
C.
D.
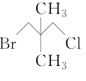
难度: 简单查看答案及解析
-
与
互为同分异构体的是
A.
B.
C.
D.
难度: 中等查看答案及解析