-
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Ag B.Cu C.Mg D.H2
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列说法中错误的是( )
A. 1mol氢气含有的原子数为2NA
B. NA个水分子中含有氢原子的物质的量为2 mol
C. 1 mol 氧气中含有的分子数为2NA
D. 含有NA个氧原子的硫酸的物质的量是0.25 mol
难度: 简单查看答案及解析
-
下列物质的属类归纳不正确的是
A.由两种或两种以上元素组成的纯净物称为化合物
B.由一种元素组成的纯净物是单质
C.由一种物质组成的称为纯净物
D.含氧元素的化合物称为氧化物
难度: 简单查看答案及解析
-
在空气中,有下列反应发生:①N2+O2═2NO;②2NO+O2═2NO2;③3NO2+H2O═2HNO3+NO;④2SO2+O2═2SO3;⑤SO3+H2O═H2SO4;⑥SO2+H2O═H2SO3;⑦3O2═2O3.其中属于氧化还原反应的是
A.①②③④ B.①②③④⑦ C.①②④⑦ D.①②③④⑤⑥⑦
难度: 中等查看答案及解析
-
磁流体是电子材料的新秀 ,将含等物质的量的 FeSO4和Fe2(SO4)3 的溶液混合,再滴入稍过量的NaOH 溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径 在 5. 5 ~ 36nm的磁流体。下列说法中正确的是
A.所得的分散系属于悬浊液
B.用光束照射该分散系能产生丁达尔效应
C.所得的分散系中分散质为 Fe2O3
D.该分散系为胶体,胶粒直径即为 Fe(OH)3 分子直径
难度: 中等查看答案及解析
-
关于铁的三种氧化物(FeO、Fe2O3、Fe3O4)的下列叙述中正确的是( )
A. 铁的三种氧化物中铁元素的化合价完全相同
B. 都是碱性氧化物,都能与盐酸反应生成氯化铁和水
C. 氧化亚铁在空气中加热可生成更稳定的四氧化三铁
D. 四氧化三铁中铁元素有+2价和+3价,它是一种混合物
难度: 中等查看答案及解析
-
高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是( )
A. 7、2 B. 5、4 C. 6、3 D. 3、6
难度: 简单查看答案及解析
-
在Na与H2O的反应中( )
A.Na是氧化剂
B.H2是氧化产物
C.反应的实质是钠置换水电离出的少量的H+
D.反应的实质是钠置换水中的氢气
难度: 简单查看答案及解析
-
下列混合物能用过滤法分离的是( )
A.酒精和水 B.食盐和蔗糖 C.泥沙和食盐 D.铜粉和铝粉
难度: 简单查看答案及解析
-
分离下列三组混合物依次采取的方法正确的是:①碳酸钙和氯化钙的溶液②植物油和氯化钠溶液③氯化钠溶液和鸡蛋清
A.渗析、蒸馏、萃取 B.分液、萃取、蒸馏
C.过滤、分液、聚沉 D.过滤、分液、渗析
难度: 中等查看答案及解析
-
能说明镁比铝还原性强的事实是( )
A. 镁的最外层电子数比铝少 B. 镁带在二氧化碳中能燃烧,而铝不能
C. 镁的密度比铝小,约为铝的
D. 铝和镁相比较,铝的硬度大、熔点高
难度: 中等查看答案及解析
-
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
经分析,某物质只含有一种元素,则该物质
A.一定是纯净物 B.可能是化合物
C.一定是混合物 D.可能是纯净物,也可能是混合物
难度: 简单查看答案及解析
-
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是 ( )
A.混合气体中含NO21.12 L B.消耗氧气的体积为1.68 L
C.此反应过程中转移的电子为0.3 mol D.参加反应的硝酸是0.4mol
难度: 中等查看答案及解析
-
将盛有氮气和二氧化氮(无N2O4)混合气体的试管倒立于水中,经过足够长时间后,试管内气体的体积缩小为原来的一半,则原混合气体中氮气与二氧化氮的体积比是( )
A. 1∶1 B. 1∶2 C. 1∶3 D. 3∶1
难度: 中等查看答案及解析
-
关于氧化剂的叙述正确的是( )
A.得电子越多,其氧化性越强
B.分子中一定含有氧元素
C.在反应中易失电子的物质
D.在反应中易结合电子的物质
难度: 简单查看答案及解析
-
当光束通过豆浆时,从侧面观察到一条光亮的“通路”,说明豆浆是
A.悬浊液 B.胶体 C.溶液 D.乳浊液
难度: 简单查看答案及解析
-
下列三个实验:①从食盐水中分离出氯化钠、②从酒精水溶液中分离出乙醇、③从碘水提取碘,其实验方法分别是( )
A. 蒸发、蒸馏、萃取 B. 萃取、蒸馏、蒸发
C. 蒸发、萃取、蒸馏 D. 蒸馏、萃取、蒸发
难度: 简单查看答案及解析
-
某国外化学教材中有一张关于氧化还原反应的插图:由图可知,
在该反应中是( )
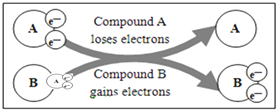
A. 还原剂 B. 氧化剂 C. 氧化产物 D. 还原产物
难度: 简单查看答案及解析
-
同温同压下,下列气体的密度最大的是( )
A.F2 B.Cl2 C.HCl D.CO2
难度: 简单查看答案及解析
-
实验室中保存下列化学药品的方法正确的是( )
A.硝酸银晶体保存在棕色试剂瓶中 B.固体烧碱保存在橡胶塞细口试剂瓶中
C.白磷保存在玻璃塞广口瓶中 D.浓盐酸可存放在敞口容器中
难度: 中等查看答案及解析
-
下列实验中能证明一种气体为SO2的是( )
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红溶液褪色 ④通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.都能证明 B.都不能证明
C.③④⑤能证明 D.只有⑤能证明
难度: 中等查看答案及解析
-
下列实验目的能够实现的是( )
A. 用托盘天平称取3.23 g NaCl固体 B. 用50 mL量筒量取30.12 mL水
C. 向小试管中加入100 mL稀盐酸 D. 用胶头滴管取约1 mL溶液
难度: 简单查看答案及解析
-
下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)
5KCl+KClO3+3H2O
难度: 中等查看答案及解析
-
刚玉(主要成分是Al2O3)是人造红宝石和蓝宝石的原料。现用废铝屑、废酸液和废碱液来生产刚玉。为达到最大生产效率,安排生产时,废铝屑分别与废酸液作用和废碱液作用的质量比为( )
A.1∶1 B.1∶2 C.1∶3 D.3∶1
难度: 中等查看答案及解析
-
在某无色酸性溶液中能大量共存的一组离子是( )
A.Na+、K+、
、
B.
、
、Al3+、
C.Na+、Ca2+、
、
D.K+、
、
、
难度: 中等查看答案及解析
 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②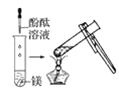 观察到的现象是________________________。
观察到的现象是________________________。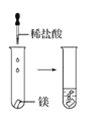 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④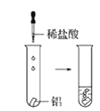 观察到的现象是________________________。
观察到的现象是________________________。