-
“远上寒山石径斜,白云深处有人家”是唐代诗人杜牧的诗句,下列关于该诗句中所涉及物质的说法正确的是
A.白云和雾霾的组成成分相同
B.白云和雾霾都只通过物理变化形成
C.若山石的主要成分为石灰石,则水泥、玻璃和炼铁工业上都要用到它
D.若山石的主要成分为正长石(K2O·Al2O3·3SiO2),则该物质在分类上属于氧化物
难度: 中等查看答案及解析
-
萜类化合物广泛存在于动植物体内,某萜类化合物如下图所示,下列说法正确的是

A.此萜类化合物的化学式为C10H14O
B.该有机物属于芳香烃
C.分子中所有碳原子均处于同一平面上
D.在浓硫酸、加热条件下,可生成两种芳香烯烃
难度: 中等查看答案及解析
-
下列操作、现象及结论均正确的是
选项
操作
现象
结论
A
用洁净的铜丝蘸取某溶液灼烧
火焰呈绿色
溶液中含有Cu2+
B
向茶水中滴加FeCl3溶液
溶液呈紫色
茶水中含有酚类物质
C
向紫色石蕊溶液中通入SO2
溶液先变红后褪色
SO2具有酸性、漂白性
D
等体积pH=3的HA和HB两种酸加水稀释相同倍数后测溶液的pH
HA的pH大
HB的酸性比HA强
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4L氩气含有的电子数为18NA
B.7.8gNa2O2中含有的阴离子总数为0.1NA
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数小于0.2 NA
D.若1LFeCl3溶液中,含NA个Fe3+,则Cl—物质的量浓度大于3 mol·L—1
难度: 中等查看答案及解析
-
如图是全钒液流储能电池的示意图,a、b是碳电极,几种含钒元素的离子在水溶液中颜色如表所列,全钒液中还含有H+、SO42-,下列说法中错误的是
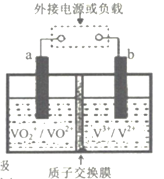
V2+
V3+
VO2+
VO2+
紫色
绿色
蓝色
黄色
A.当外接负载时,右槽溶液若逐渐由紫变绿,则b为负极
B.当外接负载时,电流若由a流出,则左槽溶液的pH增大
C.当b与外接电源负极相连时,则b极发生V3++e—=V2+
D.充电时若电路中转移0.1 mol电子,则左槽溶液中n(H+)的变化量为0.2 mol
难度: 困难查看答案及解析
-
W、N、X、Y、Z是原子序数依次增大的短周期主族元素。Y所处的周期序数与族序数相等。甲、乙、丙、丁、戊是由这些元素组成的化合物,丁是氯碱工业的-种产物,戊为二元化合物,常温下0.01 mol·L— 1戊溶液的pH为2。上述物质的转化关系如图所示。下列说法中错误的是
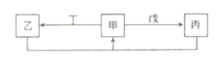
A.原子半径: N<Y<X B.W2N分子的比例模型为
C.物质丁中含有离子键和共价键 D.丙在固态时属于分子晶体
难度: 困难查看答案及解析
-
已知氢硫酸(H2S) 的电离平衡常数为: Ka1(H2S)=9.1×10—8, Ka2(H2S)=1.1×10 -12。H2S溶液中c(总)=c(H2S)+c(HS— )+c(S2— )。室温下向25.00 mL 0.1000 mol·L—1 'H2S 溶液中逐滴滴入NaOH溶液。下列说法正确的是
A.随着NaOH溶液滴入,溶液中水的电离程度不断增大
B.c(Na+ )=c(总)的溶液: c(Na +)>c(S2—)> c(H2S)> c(H+)
C.pH=7的溶液: c(Na+)>c(S2—)>c(HS— )>c(OH— )=c(H+)
D.c(H+)=9.1×10-8 mol·L-1时: c(H2S)+2c(S2— )+c(OH— )=c(Na + )+c(H— )
难度: 中等查看答案及解析
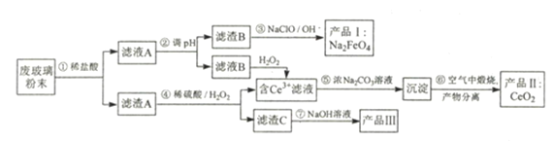
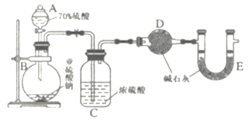
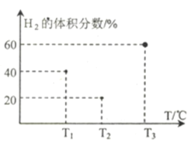
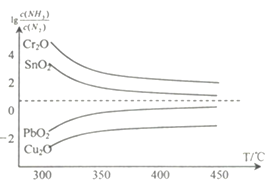
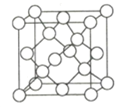
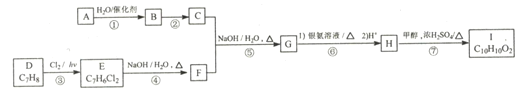
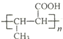 ,的合成路线(无机试剂任选)__________________
,的合成路线(无机试剂任选)__________________