-
已知氢硫酸(H2S) 的电离平衡常数为: Ka1(H2S)=9.1×10—8, Ka2(H2S)=1.1×10 -12。H2S溶液中c(总)=c(H2S)+c(HS— )+c(S2— )。室温下向25.00 mL 0.1000 mol·L—1 'H2S 溶液中逐滴滴入NaOH溶液。下列说法正确的是
A.随着NaOH溶液滴入,溶液中水的电离程度不断增大
B.c(Na+ )=c(总)的溶液: c(Na +)>c(S2—)> c(H2S)> c(H+)
C.pH=7的溶液: c(Na+)>c(S2—)>c(HS— )>c(OH— )=c(H+)
D.c(H+)=9.1×10-8 mol·L-1时: c(H2S)+2c(S2— )+c(OH— )=c(Na + )+c(H— )
高三化学单选题中等难度题查看答案及解析
-
(1)已知25℃:
H2S
一元酸HA
Ka1=9.1×10—8,Ka2=1.1×10—12,
Ka=9.1×10—10
写出H2S与钾盐KA溶液 ( A-表示酸根 ) 反应的化学方程式:______________________。
(2)次磷酸(H3PO2)是一种化工产品,具有较强的还原性。
①H3PO2是一元弱酸,写出其电离方程式____________________ 。
②H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。NaH2PO2为________(填 “正盐”或“酸式盐”),其溶液显______(填“弱酸性”、“中性”或“弱碱性”)。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_______(填化学式)。
(3)向NH4Al(SO4)2溶液中滴加1mol・L—1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化如图所示。(滴加过程无气体放出)
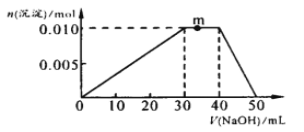
①写出m点发生反应的离子方程式_____________________________________。
②往NH4Al(SO4)2溶液中改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_____________mol 。
高三化学综合题中等难度题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
CH3COOH
HBrO(性质与HClO相仿)
H2S
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.3×10-9
Ka1=1.3×10-7
Ka2=7.1×10-13
下列说法正确的是( )
A.中和等体积、等pH的CH3COOH溶液和HBrO溶液消耗NaOH的量前者大于后者
B.等体积、等浓度的CH3COONa和NaBrO溶液中所含离子总数前者等于后者
C.物质的量浓度相等的CH3COONa、NaBrO和NaHS溶液的pH:NaBrO>NaHS>CH3COONa
D.Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
高三化学单选题中等难度题查看答案及解析
-
部分弱酸的电离常数如下表:
弱酸
HCOOH
HCN
H2S
电离平衡常数(25℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=1.3×10-7
Ka2=7.1×10-15
下列有关说法正确的是 ( )
A. 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
B. HCOO-、CN-、HS-在溶液中不可以大量共存
C. NaHS溶液中加入适量KOH后:c(Na+)=c(H2S)+c(HS-)+2C(S2-)
D. 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN
高三化学选择题困难题查看答案及解析
-
部分弱酸的电离常数如下表:
弱酸
HCOOH
HCN
H2S
电离平衡常数(25℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=1.3×10-7
Ka2=7.1×10-15
下列有关说法正确的是( )
A. 等体积、等浓度的HCOONa和NaCN两溶液中所含离子数目不相等
B. 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. HCOO-、CN-、HS-在溶液中不可以大量共存
D. NaHS溶液中加入适量KOH后:c(Na+)=c(H2S)+c(HS-)+2C(S2-)
高三化学选择题中等难度题查看答案及解析
-
部分弱酸的电离常数如下表:
弱酸
HCOOH
HCN
H2S
电离平衡常数(25℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=1.3×10-7
Ka2=7.1×10-15
下列有关说法不正确的是
A. 等体积、等浓度的HCOONa和NaCN两溶液中所含阴离子数目相等
B. HCOO-、CN-、HS-在溶液中可以大量共存
C. NaHS溶液中加入适量KOH后:c(Na+)=c(H2S)+c(HS-)+C(S2-)
D. 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
高三化学选择题中等难度题查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO
=SO
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
高三化学选择题困难题查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO
=SO
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
高三化学选择题困难题查看答案及解析
-
已知部分弱酸的电离平衡常数如下表所示
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数Ka(25℃)
1.75×10-5
2.98×10-8
Ka1=4.3×10-7
Ka2=5.61×10-11
Ka1=1.54×10-7
Ka2=1.02×10-7
下列离子方程式正确的是( )
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-=CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
高三化学单选题中等难度题查看答案及解析
-
已知部分弱酸的电离平衡常数如下表所示
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数Ka(25℃)
1.75×10-5
2.98×10-8
Ka1=4.3×10-7
Ka2=5.61×10-11
Ka1=1.54×10-7
Ka2=1.02×10-7
下列离子方程式正确的是( )
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-=CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
高三化学单选题中等难度题查看答案及解析