-
只能表示一个化学方程式的离子方程式的是
A. Cu2++2OH-+Ba2++SO42-=Cu(OH)2↓+BaSO4↓
B. CO32-+2H+=H2O+CO2↑
C. Fe(OH)3+3H+=Fe3++3H2O
D. H++OH-=H2O
难度: 简单查看答案及解析
-
某工厂废切削液中含有2%-5%的NaNO2,直接排放会造成水污染。已知NaNO2能发生反应:2NO2-+ xI- + yH+ = 2NO↑+ I2 +2H2O(已配平),下列说法不正确的是
A. 上述反应中,x=2,y=4
B. 上述反应的氧化剂与还原剂物质的量之比为1:1
C. 若反应中转移1 mol电子,则生成的NO的体积为22.4 L
D. 为使NaNO2转化为无污染的N2后再排出,可选用的试剂是NH4Cl溶液
难度: 中等查看答案及解析
-
营养学专家告诫大家:吃饭时不要同时大量食用海鲜(如虾、蟹、牡蛎等,其体内含有无毒的+5价的砷(As)元素)和某些蔬菜水果(如西红柿、土豆等,其体内富含维生素C),否则它们之间容易反应,生成剧毒的As2O3。对于产生剧毒的过程,下列叙述中,不正确的是( )
A. 维生素C能将+5价砷氧化成As2O3 B. 维生素C具有还原性
C. 维生素C在反应中作还原剂 D. 含砷物质发生了还原反应
难度: 中等查看答案及解析
-
2018年10月21日,港珠澳大桥正式开通,该桥的建成创下多项世界之最,其中仅大桥主梁使用的钢材42万吨。下列材料中不属于铁合金的是
A. 生铁 B. 铁锈 C. 不锈钢 D. 铁锰合金
难度: 简单查看答案及解析
-
下列各组中的物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是
A.Fe和FeCl3 B.Na与O2
C.NaOH与CO2 D.NaOH与AlCl3
难度: 中等查看答案及解析
-
下列关于Na和Na+的叙述中,错误的是
A.它们相差一个电子层
B.它们的化学性质相似
C.钠原子,钠离子均为同一元素
D.灼烧时,它们的焰色反应都呈黄色
难度: 简单查看答案及解析
-
以氧化铝为原料制取氢氧化铝,最好的方法是( )
A.将氧化铝溶于水
B.将氧化铝先溶于盐酸中,之后滴加氨水。
C.将氧化铝溶于盐酸,再滴加氢氧化钠溶液。
D.将氧化铝溶于氢氧化钠溶液中,之后滴加盐酸。
难度: 中等查看答案及解析
-
下列有关物质的用途中,运用了物质的化学性质的是
A.用胶状氢氧化铝凝聚水中的悬浮物进行净水
B.用红棕色氧化铁制造红色油漆
C.氢氧化铝作为医用的胃酸中和剂
D.用氧化铝制造耐火坩埚和耐火管
难度: 简单查看答案及解析
-
对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
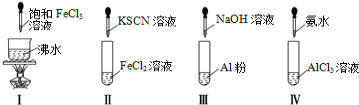
A.实验Ⅰ:产生红褐色沉淀 B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ :放出大量气体 D.实验Ⅳ:先出现白色沉淀,后溶解
难度: 中等查看答案及解析
-
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
难度: 中等查看答案及解析
-
如图所示,在烧杯中加入水和苯(苯的密度为0.88g·cm-3,与水互不相溶,且不与钠反应)各50mL,将一小粒金属钠(密度为0.97g·cm-3)投入烧杯中,观察到的现象为( )
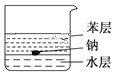
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并不断上浮、下沉
难度: 简单查看答案及解析
-
下列反应的离子方程式书写不正确的是
A.稀硫酸滴在铁片上:Fe+2H+ ==Fe2+ +H2↑
B.铜片插入硝酸银溶液中: Cu+2Ag+ =Cu2+ +2Ag
C.碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.醋酸滴在石灰石上:CaCO3 + 2CH3COOH= Ca2++2CH3COO-+CO2↑+H2O
难度: 中等查看答案及解析
-
某化学小组以铝土矿(含 Al2O3、Fe2O3和 SiO2)为原料进行炼铝探究(流程如下),叙述错误的是

A. 步骤①②过程中均需过滤操作
B. a、b中铝元素的化合价相同
C. 反应③的化学方程式为:2 NaAlO2+3H2O+CO2 = 2Al(OH)3↓+Na2CO3
D. d只能是氧化铝
难度: 中等查看答案及解析
-
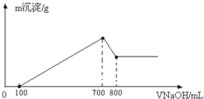
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,加入NaOH溶液的体积(v)和生成沉淀的质量(m)之间的关系如如图所示,其中正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2 H2O = NaBO2+ 4H2↑下列说法中正确的是(NaBH4中B元素为+3价)
A.NaBH4既是氧化剂以是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1∶1
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是
选项
实验
现象
结论或解释
A
将Cu片放入FeCl3溶液中
溶液棕黄色变为浅绿色
铁比铜还原性强
B
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落下来
铝箔表面有致密Al2O3薄膜,且A12O3熔点高于Al
C
向新收集的酸雨中滴加硝酸钡溶液
产生白色沉淀
酸雨中一定含有SO42-
D
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现血红色。则由此得出下列的结论错误的是
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+
D.Fe2+与SCN-不能形成血红色的化合物
难度: 中等查看答案及解析
-
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
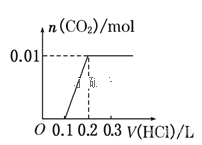 B.
B.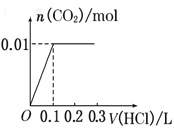
C.
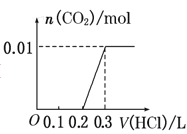 D.
D.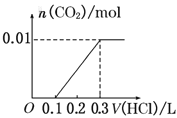
难度: 困难查看答案及解析