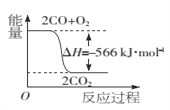
-
离子键、共价键、金属键、范德华力都是微粒之间的不同作用力,下列物质:①Na2O2②SiO2③氦气 ④金刚石 ⑤NH4Cl ⑥白磷 含有上述任意两种作用力的是( )
A.①②④ B.①③⑥ C.①⑤⑥ D.③④⑤
难度: 中等查看答案及解析
-
下列说法中错误的是:
A.SO2、SO3都是极性分子 B.在NH4+和[Cu(NH3)4]2+中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
难度: 中等查看答案及解析
-
在核电荷数为26的元素Fe的基态原子核外的3d、4s轨道内,下列电子排布图正确的是
A.
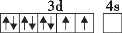 B.
B.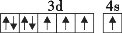
C.
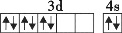 D.
D.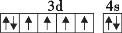
难度: 简单查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2 B.NaCl和HCl C.CCl4和KCl D.CO2和H2O
难度: 简单查看答案及解析
-
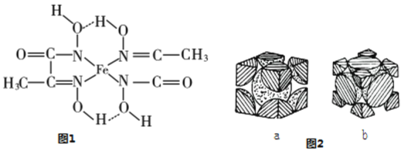
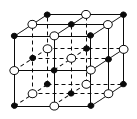
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示,下列说法正确的是
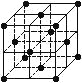
A.C60摩尔质量是720
B.C60属于离子晶体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
难度: 中等查看答案及解析
-
下列有关元素周期表和元素周期律的说法,错误的是
①元素周期表中s区、d区和ds区的元素都是金属元素
②d区元素最后一个核外电子一定填充在s能级上
③原子核外电子的能层越多,原子半径越大
④同一周期自左至右,元素的第一电离能依次增大
A.只有①②③ B.只有②③ C.只有③④ D.①②③④
难度: 简单查看答案及解析
-
下列有关晶体的叙述中不正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.1mol SiO2晶体中含2mol Si-O键
C.干冰晶体中每个CO2分子周围紧邻12个CO2分子
D.金刚石晶体中的最小环由6个碳原子构成
难度: 简单查看答案及解析
-
用 VSEPR 模型预测下列分子或离子的立体结构,其中正确的是( )
A.H2O 与 BeCl2为V 形 B.CS2 与SO2为直线形
C.SO3 与CO32-为平面三角形 D.BF3 与PCl3为三角锥形
难度: 简单查看答案及解析
-
“类推”是一种重要的学习方法,但有时会产生错误结论,下列类推结论中正确的是
A.碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI
B.ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子
D.若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述错误的是
A.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
B.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
C.常温常压下,5 gD2O含有的质子数、电子数、中子数均为2.5NA
D.2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是
A.已知2C(s)+2O2(g)=2CO2(g) △H= ak J/mol、2C(s)+O2(g)=2CO(g) △H= bk J/mol, 则a>b
B.甲烷的燃烧热为890kJ/mol,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
C.已知P(s,白磷)=P(s,红磷)△H<0,则白磷比红磷稳定
D.已知HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量
难度: 中等查看答案及解析
-
已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g)△H3 4Fe(s)+3O3(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0 B.△H1>△H2
C.△H1=△H2+△H3 D.△H3=△H4+△H5
难度: 中等查看答案及解析
-
下列有关图象的叙述正确的是
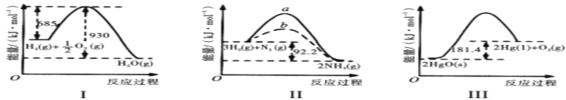
A.图I: H2的燃烧热为245 kJ/mol
B.图II:b可能为使用催化剂的曲线,催化剂不能改变该反应的焓变
C.图II:向容器中充入1mol N2、3molH2,充分反应后放出热量92.2 kJ
D.图III:HgO(s)=Hg(l)+
O2(g)△H=-90.7 kJ/mol
难度: 中等查看答案及解析
-
已知,在25℃、101 kPa时:① C(s)+O2(g)==CO2(g) ΔH=-393.5 kJ/mol
② 2C(s)+O2(g)==2CO(g) ΔH=-221.0 kJ/mol
③ 2H2(g)+O2(g)==2H2O(g) ΔH=-483.6 kJ/mol
下列判断不正确的是
A.6g碳完全燃烧时放出热量196.8 kJ
B.CO的燃烧热ΔH=-283.0 kJ/mol
C.H2的燃烧热ΔH=-241.8 kJ/mol
D.制备水煤气的反应热ΔH=+131.3 kJ/mol
难度: 中等查看答案及解析
 。
。