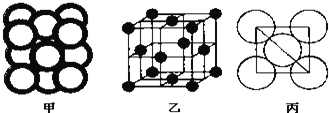
-
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
A. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
C. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
难度: 中等查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关,下列说法正确的是
A.利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应
B.蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量
C.为了提高生活用水的卫生标准,自来水厂常使用
和
进行消毒、净化、以改善水质
D.塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的
难度: 中等查看答案及解析
-
下列物质间的转化,能经过化合反应一步直接转化的是
A.SiO2→H2SiO3 B.Na2O2→Na2CO3 C.Fe→FeCl2 D.Al2O3→Al(OH)3
难度: 中等查看答案及解析
-
下列实验中,对应的操作、现象以及结论均正确的是( )
选项
实验操作
实验现象
结论
A
将铜粉加入到浓硫酸中
无明显现象
铜被浓硫酸钝化
B
将表面氧化的钢丝从酒精灯的外焰慢慢移向内焰
黑色的铜丝变红色
氧化铜被酒精灯内焰的乙醇蒸汽还原
C
将混有乙酸的乙酸乙酯加入到分液漏斗中,加入氢氧化钠溶液,震荡、静置、分液
溶液分层
除去乙酸乙酯中的乙酸
D
分别向两只试管中加入同浓度、同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高猛酸钾溶液
酸性高锰酸钾溶液褪色时间不同
浓度不同反应速率不同
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列物质的转化在指定条件下能实现的是
①Cu
Cu2(OH)2CO3
CuO
②CaCl2(aq)
CaCO3
CaSiO3
③MgO
MgCl2(aq)
MgCl2(s)
④N2
NO2
HNO3
⑤Cl2
NaClO
Cl2
A.①④⑤ B.①②⑤ C.②③⑤ D.①②④
难度: 简单查看答案及解析
-
红珊瑚栖息于200~2000 m的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥的象征,一直用来制作珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是( )
A.Na B.Fe C.Si D.Cu
难度: 简单查看答案及解析
-
通常条件下,下列物质能用化合反应制得的是
A.
B.
C.
D.CuS
难度: 简单查看答案及解析
-
某澄清透明溶液中只可能含有①
,②
,③
,④
,⑤
,⑥
,⑦
中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
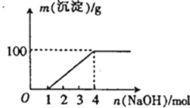
A.②⑤⑥⑦ B.②③⑤⑦ C.①②③⑥⑦ D.①②③④⑤⑦
难度: 中等查看答案及解析
-
有六种溶液,分别含有下列阳离子:
、
、
、
、
、
,只选用一种试剂将它们一一鉴别,该试剂可以是( )
A.
溶液 B.
溶液 C.稀氨水 D.NaOH溶液
难度: 中等查看答案及解析
-
本草经集注
记载:“鸡屎矾
碱式硫酸铜或碱式碳酸铜
不入药用,惟堪镀作,以合熟铜;投苦酒
醋
中,涂铁皆作铜色,外虽铜色,内质不变。”下列说法错误的是( )
A.鸡屎矾属有机物
B.铜盐溶液可与铁发生置换反应
C.碱式碳酸铜不稳定,受热易分解
D.鸡屎矾投苦酒中发生是非氧化还原反应
难度: 中等查看答案及解析
-
实验室常采用点滴板来完成部分实验,既可节约药品,又便于观察实验现象,图中所示的实验现象描述正确的是
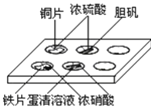
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有蛋清溶液的孔穴中溶液呈黄色。
A.① B.②③ C.①④ D.②④
难度: 中等查看答案及解析
-
化学与社会、生产、生活密切相关,下列说法正确的是( )
A.
可用于检验酒精中是否含有水
B.
是指大气中直径小于或等于
微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因
C.自来水厂用明矾净水,用
或
均能代替明矾净水
D.海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘的步骤有:灼烧
浸泡
过滤
萃取
粗碘提纯
难度: 中等查看答案及解析
-
下列有关金属及其合金的说法不正确的是
A. 目前我国流通的硬币是由合金材料制成的
B. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C. 出土的古代铜制品表面覆盖着铜绿,其主要成分是CuO
D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
难度: 中等查看答案及解析
-
下列描述或化学用语书写错误的是
A.向Fe(OH)3胶体中滴加稀硫酸,先生成红褐色沉淀,后沉淀逐渐溶解
B.向铜粉中加入稀硫酸,铜粉不溶解,再加入硝酸钾固体,铜粉逐渐溶解
C.氯碱工业和金属钠的冶炼都用到了NaCl,阳极上发生的电极反应都是:2Cl- - 2e- = Cl2↑
D.向明矾[KAl(SO4)2·12H2O]溶液中滴入Ba(OH)2溶液,SO42-恰好完全沉淀时的离子方程式为:Ba2++3OH-+Al3++SO42-=BaSO4↓+Al(OH)3↓
难度: 中等查看答案及解析
-
下列过程不涉及氧化还原反应的是
A.火法炼铜
B.中和滴定
C.酿酒
D. 制银镜
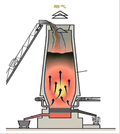
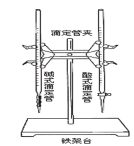


A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是
① FeS2
SO2
H2SO4
②SiO2
SiCl4
Si
③ 饱和NaCl溶液
NaHCO3
Na2CO3
④ 1 mol·L-1HCl(aq)
Cl2
Ca(ClO)2
⑤ CuSO4(aq)
Cu(OH)2
Cu2O
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
难度: 中等查看答案及解析
-
我国古代科技十分发达,下列对古文献的解释不正确的是
序号
古文
解释
A
烧酒非古法也,自元时创始,其法用浓酒和糟入甑
指蒸锅
,蒸令气上,用器承滴露
白酒
烧酒
的制造过程中采用了蒸馏的方法来分离和提纯
B
白青
碱式碳酸铜
得铁化为铜
可以用铁来冶炼铜
C
初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之
蔗糖的分离提纯采用了黄泥来吸附红糖中的色素
D
丹砂烧之成水银,积变又成丹砂
加热时丹砂
熔融成液态,冷却时重新结晶为HgS晶体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列反应中,调节反应物用量与浓度不会改变反应产物的是( )
A.
通入石灰水 B.NaOH溶液滴入
溶液
C.硫酸中加入锌粉 D.
溶液中滴入NaOH溶液
难度: 中等查看答案及解析