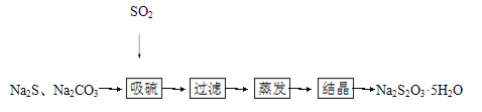
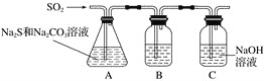
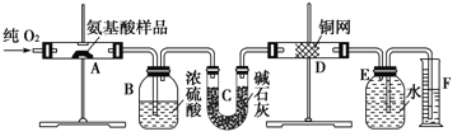
-
CH3CH2C≡CH的化学性质主要取决于( )
A. 碳碳单键 B. 碳碳双键
C. 碳碳叁键 D. 碳氢键
难度: 简单查看答案及解析
-
某气态烃0.5 mol能与1 mol HCl完全加成,加成后的产物分子上的氢原子又可被3 mol Cl2完全取代。则此气态烃可能是( )
A.HC≡CH B.CH2=CH2 C.HC≡C-CH3 D.CH2=C(CH3)CH3
难度: 简单查看答案及解析
-
数据:7.2×10﹣4、4.6×10﹣4、4.9×10﹣10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2===HCN+NaNO2,②NaCN+HF====HCN+NaF,③NaNO2+HF===HNO2+NaF。由此可判断下列叙述中,不正确的是( )
A.HF的电离平衡常数为7.2×10﹣4
B.HNO2的电离平衡常数为4.9×10﹣10
C.根据①③两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
难度: 中等查看答案及解析
-
下列反应属于吸热反应的是
①锌粒与稀H2SO4反应制取H2 ②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳 ④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解 ⑧钢铁制品生锈的反应
A. ③⑤⑥⑦⑧ B. ③⑤⑥ C. ①③④⑤⑥⑧ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
下列实验操作中,先后顺序正确的是( )
A. 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
B. 检验某溶液中是否含SO42﹣,应先加入BaCl2溶液,再加入稀硝酸
C. 滴定管洗净后应先用蒸馏水润洗,然后再注入标准液进行滴定
D. 在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
难度: 中等查看答案及解析
-
下列有机物既能在常温下溶于水,又能发生银镜反应的是( )
A.甲醇 B.甲酸乙酯 C.葡萄糖 D.苯酚
难度: 中等查看答案及解析
-
下列有关金属腐蚀的说法中正确的是
①金属的腐蚀全部是氧化还原反应
②金属的腐蚀可分为化学腐蚀和电化学腐蚀,只有电化学腐蚀才是氧化还原反应
③因为二氧化碳普遍存在,所以钢铁的电化学腐蚀以析氢腐蚀为主
④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化
A. ①③ B. ②③ C. ①④ D. ①③④
难度: 中等查看答案及解析
-
中和热测定实验中,下列操作一定会降低实验准确性的是( )
A.用滴定管取所用药品
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
难度: 简单查看答案及解析
-
在相同温度下,100 mL 0.01 mol·L-1醋酸溶液与10 mL 0.1 mol·L-1醋酸溶液相比,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.CH3COOH的电离程度
C.H+的物质的量浓度 D.CH3COOH的物质的量
难度: 中等查看答案及解析
-
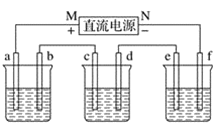
如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,
下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
难度: 简单查看答案及解析
-
等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)
3Z(g)+Q(s) △H>0,下列叙述正确的是
A.当容器中X与Y的物质的量之比满足1∶2时反应达到平衡
B.达到平衡时X的转化率为25%,则平衡常数K为9/4
C.达到平衡后,反应速率2v正(Y)=3v逆(Z)
D.达到平衡后,加入Q,平衡逆向移动
难度: 中等查看答案及解析
-
某二元酸H2A在水中发生电离:H2A=H++HA-,HA-
H++A2-。下列叙述中不正确的是
A.在NaHA溶液中c(Na+)>c (HA-)> c(H+) >c (OH-)
B.在Na2A溶液中c (Na+)=2c (A2-)+2c(HA-)+2c (H2A)
C.在Na2A溶液中c (OH-) =c (HA-)+ c (H+)
D.在H2A溶液中c (H+)=c (HA-)+2c (A2-)+c (OH-)
难度: 中等查看答案及解析
-
美籍华裔化学家钱永健是诺贝尔化学奖获得者。少年时代,他就对化学产生了浓厚的兴趣。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是( )
A.金属腐蚀就是金属原子失去电子被还原的过程
B.合金都比纯金属易被腐蚀
C.将金属与外加直流电源的负极相连,可以防止金属被腐蚀
D.镀锌铁比镀锡铁更容易被腐蚀
难度: 中等查看答案及解析
-
下列不能用焓判据解释的自发进行的过程是( )
A. 铁在潮湿空气中生锈了 B. 天然气的燃烧
C. 铜在潮湿空气中产生铜绿 D. NH4Cl与Ba(OH)2·8H2O反应产生NH3
难度: 简单查看答案及解析
-
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧ B.②④⑥⑧ C.①⑥ D.②④⑦
难度: 简单查看答案及解析
-
如图是198 K时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
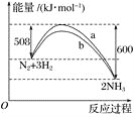
A.该反应的热化学方程式为N2+3H2
2NH3ΔH=-92 kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.升高温度,反应速率加快
难度: 中等查看答案及解析
-
下列事实可证明NH3·H2O是弱碱的是( )
A.氨水能与氯化镁反应生成氢氧化镁
B.氨水能与硫酸发生中和反应
C.0.2 mol·L-1氨水与0.2 mol·L-1盐酸等体积混合后,溶液pH约为5
D.氨水可以使酚酞溶液变红
难度: 中等查看答案及解析
-
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。下列说法正确的是( )
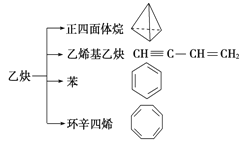
A.正四面体烷的分子式为C4H4,其二氯代物有两种
B.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
C.苯为平面六边形结构,分子中存在C—C和C==C,能使酸性KMnO4溶液褪色
D.环辛四烯跟苯的结构很像,不能使溴水褪色
难度: 中等查看答案及解析
-
下列粒子的电子式正确的是( )
A.
B.
C.
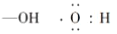
D.

难度: 简单查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
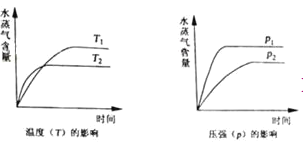
A.CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)
CO(g)+H2O(g);△H>0
C.CH3CH2OH (g)
CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)
2 C6H5CH=CH2(g)+2H2O(g);△H<0
难度: 中等查看答案及解析
-
常温下用石墨作电极,电解100 mL 0.1 mol·L-1的Cu(NO3)2和0.1 mol·L-1的AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12 L 时,假设溶液体积不变,下列说法正确的是( )
A. 阴极增重1.4 g B. 所得溶液pH<1
C. 阴极增重0.64 g D. 所得溶液pH>1
难度: 中等查看答案及解析
-
下列物质中可作净水剂的是( )
A.胆矾 B.明矾 C.绿矾 D.皓矾
难度: 中等查看答案及解析
-
对于可逆反应2SO2+O2
2SO3 ΔH<0,在混合气体中充入一定量的18O2,足够长时间后18O( )
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于O2和SO2中 D.存在于SO2、O2和SO3中
难度: 中等查看答案及解析
-
在1200 ℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=
S2(g)+2H2O(g) ΔH2
③H2S(g)+
O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=
(ΔH1+ΔH2-3ΔH3) B.ΔH4=
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=
(ΔH1+ΔH2-3ΔH3) D.ΔH4=
(ΔH1-ΔH2-3ΔH3)
难度: 简单查看答案及解析
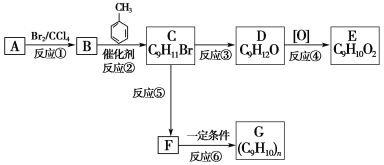
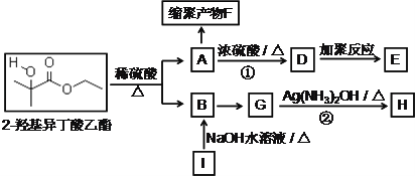
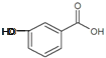 的说法正确的有______(双选,填字母);
的说法正确的有______(双选,填字母);