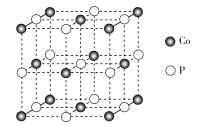
-
化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是( )
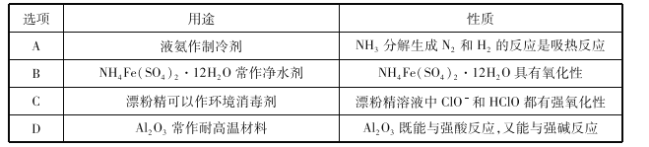
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
R是合成某高分子材料的单体,其结构简式如图所示。下列说法错误的是( )
A.R能发生加成反应和取代反应
B.用NaHCO3溶液可检验R中是否含有羧基
C.R与HOCH2COOH分子中所含官能团完全相同
D.R苯环上的一溴代物有4种
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1mol
中共平面的碳原子数最多为6NA
B.1L0.5mol/LKHC2O4溶液中含HC2O4-和H2C2O4的数目为0.5NA
C.25℃、1.01×105 Pa下,44.8LSO2和CO2的混合气体中所含分子数为2NA
D.12.0gNaHSO4和MgSO4的固体混合物中所含阳离子总数为0.1NA
难度: 中等查看答案及解析
-
下列实验能达到实验目的的是( )

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
近日,中国第36次南极科学考察队暨“雪龙2”号从深圳启航,前往南极执行科考任务。下列说法正确的是( )
A.外壳镶嵌一些铅块等可提高科考船的抗腐蚀能力
B.利用牺牲阳极的阴极保护法保护船体,正极反应式为O2-4e-+2H2O=4OH-
C.停靠期间可以采用外加电流的阴极保护法,电源负极与船体相连接
D.科考船只能采用电化学保护法提高其抗腐蚀能力
难度: 中等查看答案及解析
-
短周期主族元素R、X、Y、Z的原子序数依次增大,R、Y位于同主族,X2 YR3水溶液在空气中久置,其溶液由碱性变为中性。下列说法正确的是( )
A.简单离了半径:X>Y>Z>R
B.X2Y与Z2反应可证明Z的非金属性比Y强
C.Y的氧化物对应的水化物一定是强酸
D.X和R组成的化合物只含一种化学键
难度: 中等查看答案及解析
-
已知AG=lg
,电离度α=
 ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。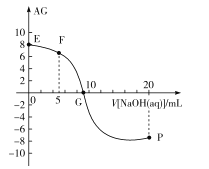
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
难度: 困难查看答案及解析