-
在多电子原子中,轨道能量是由以下哪些因素决定( )
①能层 ②能级 ③电子云的伸展方向 ④电子自旋状态
A. ①② B. ①④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是
A. C60是一种新型的化合物
B. C60和石墨都是碳的同素异形体
C. C60中虽然没有化学键,但固体为分子晶体
D. C60相对分子质量为720g/mol
难度: 简单查看答案及解析
-
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合面成:①CH3COONa与HCl ②CH3COONa与NaOH ③CH3COONa与NaCl ④CH3COONa与NaHCO3下列各项排序正确的是( )
A.pH:②>③>④>① B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
难度: 中等查看答案及解析
-
下列反应属于吸热反应的是
①锌粒与稀H2SO4反应制取H2 ②氢气在氧气中燃烧
③碳酸钙高温分解成氧化钙和二氧化碳 ④氢氧化钾和硫酸中和
⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥氢气还原氧化铜
⑦葡萄糖在人体内氧化分解 ⑧钢铁制品生锈的反应
A. ③⑤⑥⑦⑧ B. ③⑤⑥ C. ①③④⑤⑥⑧ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
下列物质的熔、沸点由大到小的是( )
A.CH4、NH3、H2O、HF B.H2O、HF、NH3、CH4
C.HF、CH4、NH3、H2O D.HF、H2O、CH4、NH3
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
下列说法正确的是
A.溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
B.溶度积常数是不受任何条件影响的常数,简称溶度积
C.可用离子积Qc判断沉淀溶解平衡进行的方向
D.所有物质的溶度积都是随温度的升高而增大的
难度: 简单查看答案及解析
-
已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+
H2(g)=
C2H2(g)ΔH2
③C(s)+ H2(g)=
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A.ΔH2 >ΔH3 >ΔH1 B.ΔH3 >ΔH2 >ΔH1
C.ΔH3 >ΔH1 >ΔH2 D.ΔH1 >ΔH2 >ΔH3
难度: 简单查看答案及解析
-
在25℃时,用蒸馏水稀释l mol• L-1氨水至0.01 mol• L-1,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.c(OH-) B.c(NH4+)/c(OH-) C.c(NH3•H2O)/c(NH4+) D.c(OH-)/c(NH3•H2O)
难度: 中等查看答案及解析
-
已知反应2CO(g)=2C(s)+O2(g) 的
为正值,
为负值。设
和
不随温度而变,下列说法中正确的是
A.低温下能自发进行 B.任何温度下都不能自发进行
C.低温下不能自发进行,高温下能自发进行 D.高温下能自发进行
难度: 简单查看答案及解析
-
在恒容条件下化学反应:2SO2(g)+O2(g)
2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
容器
SO2(mol)
O2(mol)
N2(mol)
Q(kJ)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1molSO3固体放热
kJ
B.2Q1<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
难度: 中等查看答案及解析
-
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
难度: 中等查看答案及解析
-
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
难度: 中等查看答案及解析
-
下列反应中属于可逆反应的是( )
①N2+3H2
2NH3,2NH3
3H2+N2
②2NaHCO3
Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
③CH3CH2OH
CH2===CH2↑+H2O,CH2===CH2+H—OH
CH3CH2OH
④2Na+Cl2
2NaCl, 2NaCl
2Na+Cl2
A.只有① B.①②③
C.①②③④ D.①③④
难度: 中等查看答案及解析
-
对常温下0.1mol/L的醋酸溶液,以下说法正确的是
A.由水电离出来的c(H+)=1.0×10-13mol/L
B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C.与同浓度的盐酸分别加水稀释10倍:pH(醋酸) <pH(盐酸)
D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)=0.1mol/L
难度: 中等查看答案及解析
-
能影响水的电离平衡,并使溶液中c(OH-)>c(H+)操作是( )
A.加入Na2CO3固体 B.加入NaNO3固体
C.加入NaHSO4固体 D.加入(NH4)2SO4固体
难度: 简单查看答案及解析
-
某离子化合物的晶胞结构如图所示,则该晶体中X、Y的离子个数之比是
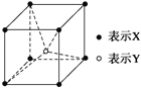
A.4:1 B.1:1 C.2:1 D.1:2
难度: 简单查看答案及解析
-
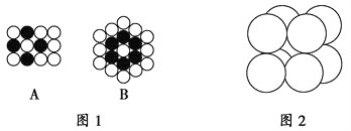
如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )

A.γFe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.αFe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.三种同素异形体的性质相同
难度: 中等查看答案及解析
-
金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
和
的说法中正确的是
A.
和
的质量数相同,互称为同位素
B.
和
的质子数相同,互称为同位素
C.
和
的质子数相同,是同一种核素
D.
和
核外电子数相同,中子数不同,不能互称为同位素
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.一个水分子与其他水分子间只能形成2个氢键
B.含氢键的分子熔、沸点一定升高
C.分子间作用力包括氢键和范德华力
D.当H2O由液体变为气体时只破坏了氢键
难度: 中等查看答案及解析
-
下列表示式中错误的是( )
A.Na+的电子式:
B.Na+的结构示意图:
C.Na的电子排布式:1s22s22p63s1
D.Na的简化电子排布式:[Ne]3s1
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测NH3和BF3的空间构型,结论正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.三角锥形;平面三角形 D.直线形;平面三角形
难度: 中等查看答案及解析
-
下列中,属于原子晶体的是( )
A.干冰 B.金刚石 C.碳酸钙 D.烧碱
难度: 简单查看答案及解析
-
下列各离子的电子排布式错误的是( )
A.Na+ 1s22s22p6 B.F- 1s22s22p6 C.N3+ 1s22s22p6 D.O2- 1s22s22p6
难度: 中等查看答案及解析