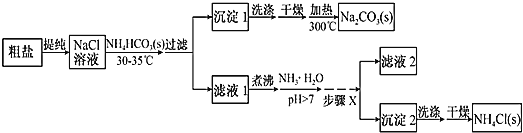
-
化学与工业、生活、社会发展息息相关,下列有关说法不正确的是( )
A.电解质溶液导电、煤的气化、石油的裂解、烧碱的潮解都是化学变化
B.《梦溪笔谈》中所描述的“熬胆矾铁釜久之亦化为铜”,该过程中发生了置换反应
C.在呼吸面具和潜水艇中可用
作供氧剂
D.医用硫酸亚铁片和维生素C同时服用、能增强治疗缺铁性贫血的效果
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1mol
发生氧化还原反应时,转移的电子数目一定为2NA
B.向含有1mol
的溶液中通入足量的氯气完全反应时,转移的电子数目为2NA
C.常温常压下,14g由
与
组成的混合气体含有的原子数目为NA
D.
的浓硫酸与足量铜在加热条件下反应,生成
分子的数目为0.46NA
难度: 中等查看答案及解析
-
下列有关实验现象、结论或解释均正确的是( )
选项
实验操作
实验现象
结论或解释
A
用镊子夹取一块金属钠并用滤纸吸干表面的煤油,用小刀切开一端的外皮
切口处呈银白色,很快变成淡黄色
常温下,钠与O2反应生成了Na2O2
B
用坩埚钳夹住一块表面用砂纸打磨过的铝箔在酒精灯上加热一会儿
铝箔在空气中剧烈燃烧,并有白色固体物质滴落下来
铝与O2在加热时生成了Al2O3
C
做焰色反应实验时,某同学用洁净的铂丝蘸取样品在无色火焰上灼烧
直接观察到火焰的颜色呈黄色
该样品中含有钠元素,一定不含钾元素
D
将等浓度的Na2CO3和NaHCO3溶液分别盛放于两支试管中,然后各滴加1~2滴酚酞
溶液均变成红色,但Na2CO3溶液颜色更深一些
同浓度时Na2CO3溶液碱性更强
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关离子反应方程式书写正确的是( )
A.向
溶液中加入过量的氨水:
B.将绿豆大小的一块金属钠放入盛水的烧杯中:
C.向
溶液中加入少量的
溶液:
D.向
溶液中加入过量的
溶液:
难度: 中等查看答案及解析
-
实验室欲用
晶体来配制
的
溶液100mL,下列有关说法正确的是( )
A.要完成实验需称取16.0g
晶体
B.本实验只需要用到的仪器有托盘天平、药匙、玻璃棒、烧杯、100mL的容量瓶
C.定容时俯视刻度线会导致所配溶液浓度偏高
D.配制时若容量瓶不干燥,含有少量的蒸馏水,会导致溶液浓度偏低
难度: 中等查看答案及解析
-
为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(
)。碘酸钾和碘化钾在溶液中能发生如下反应:
。下列有关叙述正确的是( )
A.该反应中氧化剂为
,还原剂为
B.该反应中,每生成3mol
时转移的电子数目为5NA
C.上述反应中,氧化产物与还原产物的质量之比为1:5
D.直接向食盐中加入淀粉溶液,可以判断该食盐是否为加碘食盐
难度: 中等查看答案及解析
-
某溶液中只可能含有
、
、
、
、
、
、
、
中的若干种离子,且所含有的离子浓度均为
。某同学为确定其成分,进行如图所示实验:
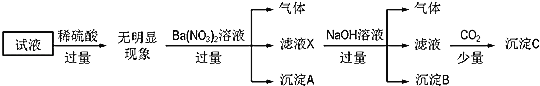
下列说法正确的是( )
A.无法确定原试液中是否含有
、
B.滤液X中大量存在的阳离子有
、
和
C.无法确定沉淀C的成分
D.原溶液中存在的离子为
、
、
、
难度: 困难查看答案及解析
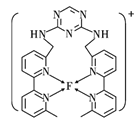
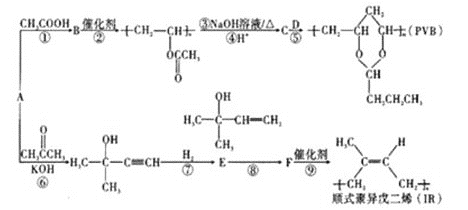
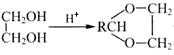 +H2O;
+H2O;