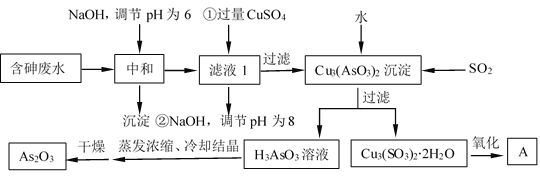
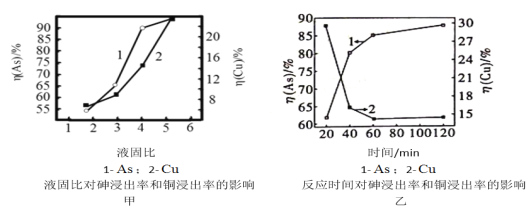
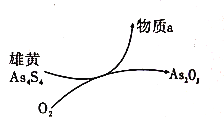
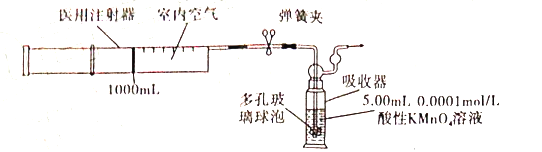
-
甲烷在工农业生产、生活中有着重要作用,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)∆H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)∆H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则∆H2=_________。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是_______(填序号)。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=________________,该温度下反应的平衡常数K=_______________。(答案可用分数表示)
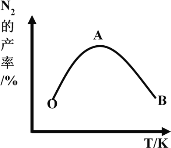
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是_________。
(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是__________(填序号)。
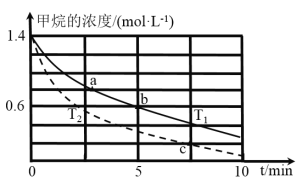
A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为_______。
难度: 中等查看答案及解析
-
本题涉及部分铜及其化合物的相关结构问题的考查,请回答下列问题。
(1)写出基态Cu2+的核外电子排布式:________。Cu的同周期元素中,与铜原子最外层电子数相等的元素原子还有___________(用元素符号表示)。
(2)从原子结构角度分析高温Cu2O比CuO稳定的原因是___________。
(3)[Cu(NH3)2]Ac可用于合成氨工业中的铜洗工序,除去进人合成塔前混合气中的CO(CO能使催化剂中毒)。
①Ac表示CH3COO-,Ac中碳原子的杂化方式为________。
②[Cu(NH3)2]Ac能够结合CO的原因是________。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
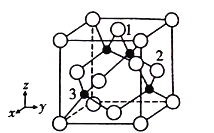
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于________填(“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
,
,1),则原子2和3的坐标分别为___________、__________。
③已知该晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____________pm(只写计算式)。
难度: 中等查看答案及解析
-
甲苯是重要的基础化工原料,下图是大学化学教材《有机化学基础》上由甲苯合成J的一种合成路线。
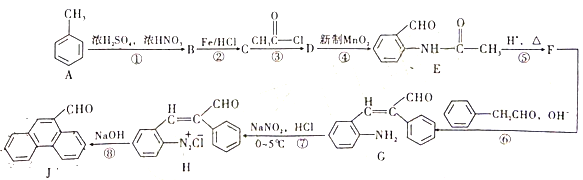
请依据上述流程回答以下问题
(1)B的化学名称为___________,J的分子式为___________。
(2)D生成E的反应类型为___________。
(3)设计第③步和第⑤步的目的是______________。
(4)由H生成J过程中生成的无机物除了
外还有_________。
(5)写出C→D的反应方程式为_______。
(6)D的同分异构体有多种。其中含有苯环和碳氧双键,且核磁共振氢谱有四组峰的有_________种。(不考虑立体异构)
(7)请依据流程图中相关信息,写出由甲苯和乙醛制备
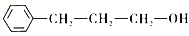 的合成路线________。(无机试剂任选)
的合成路线________。(无机试剂任选)难度: 中等查看答案及解析