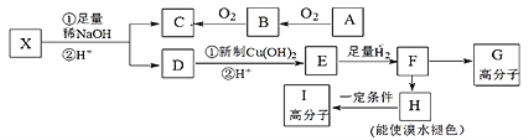
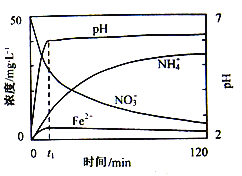
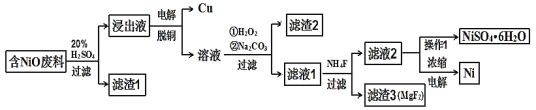
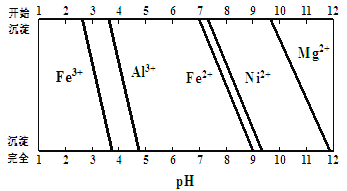
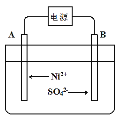
-
化学与生活、能源、环境等密切相关。下列描述错误的是( )
A.采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
B.“雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关
C.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是单质硅
D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.0.1mol MnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
B.0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA
C.分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
D.用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA
难度: 中等查看答案及解析
-
下列与NH4Fe(SO4)2·24H2O溶液有关描述及离子方程式正确的是( )
A.该溶液中H+、Fe2+、SCN-、Br-可以大量共存
B.该溶液中滴入少量NaOH溶液:3NH4++Fe3++6OH-=3NH3↑+Fe(OH)3↓+3H2O
C.该溶液中加入足量的Zn粉:2Fe3++Zn=Zn2++2Fe2+
D.先加盐酸再加入BaCl2溶液:SO42-+Ba2+=BaSO4↓
难度: 中等查看答案及解析
-
下列①②对应的试剂(或条件)不能完成实验目的的是( )
实验目的
试剂(条件)
A
温度对Na2S2O3溶液与H2SO4溶液反应速率的影响
①热水浴②冷水浴
B
用Na块检验乙醇分子存在不同于烃分子里的氢原子
①乙醇②煤油
C
用硝酸酸化的AgNO3溶液检验自来水中能否蒸馏除去Cl-
①自来水②蒸馏水
D
催化剂对H2O2分解速率的影响
①0.1mol/LFeCl3
②0.2mol/LFeCl3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的-CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
难度: 中等查看答案及解析
-
水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点。以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe-=NaLixV3O8,则下列说法不正确的是( )
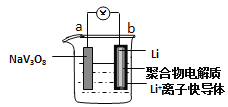
A.充电过程中阳极的电极反应式为NaLixV3O8-xe-=NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化
B.充电过程中Li+从阳极向阴极迁移
C.放电时,负极的电极反应式:Li-e-=Li+
D.该电池可以用硫酸锂溶液作电解质
难度: 中等查看答案及解析
-
25℃时,取浓度均为0.1000mol/L的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol/LNaOH溶液、0.1000mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示,下列说法不正确的是( )
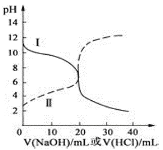
A.由滴定曲线,25℃时Ka(CH3COOH)=Kb(NH3·H2O)=10-5
B.当NaOH溶液和盐酸滴加到20.00mL时,曲线Ⅰ和Ⅱ刚好出现交点
C.曲线Ⅱ:滴加溶液到10.00mL时,溶液中c(CH3COO-)+c(OH-)>c(H+)
D.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
难度: 困难查看答案及解析
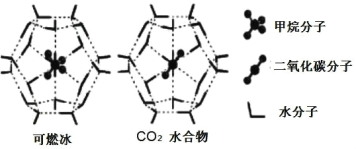
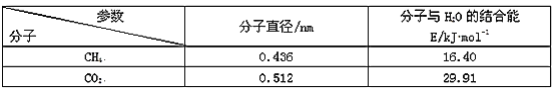
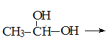 CH3-CHO+H2O
CH3-CHO+H2O