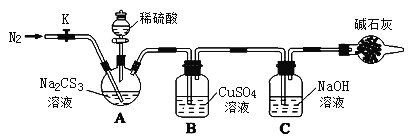
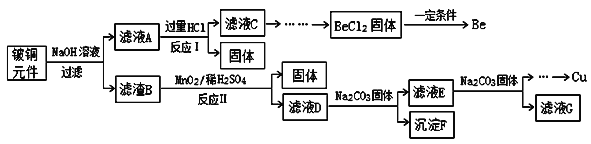
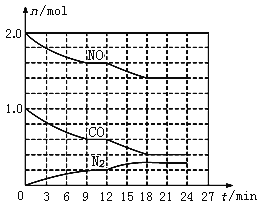
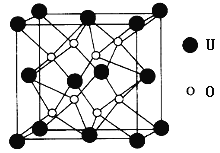
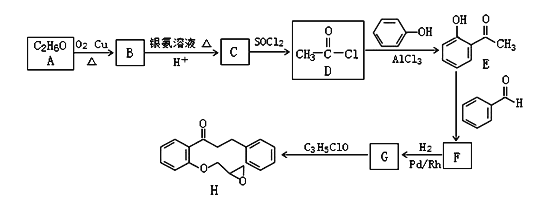
-
下列生活用品中主要由合成纤维制造的是( )
A. 尼龙绳 B. 宣纸 C. 羊绒衫 D. 棉衬衣
难度: 中等查看答案及解析
-
下列常见物质的俗名与化学式对应正确的是
A.水煤气-CH4 B.明矾-KAl(SO4)2·12H2O
C.水玻璃-H2SiO3 D.纯碱-NaHCO3
难度: 简单查看答案及解析
-
改变下列条件,只对化学反应速率有影响,一定对化学平衡没有影响的是
A.催化剂 B.浓度 C.压强 D.温度
难度: 中等查看答案及解析
-
下列化学用语或命名正确的是
A.过氧化氢的结构式:H-O-O-H B.乙烯的结构简式:CH2CH2
C.含有8个中子的氧原子:
D.NH4Cl的电子式:
难度: 简单查看答案及解析
-
下列常见的金属中,常用电解法冶炼的是
A.Fe B.Cu C.Mg D.Pt
难度: 简单查看答案及解析
-
下列关于甲烷、乙烯、苯和乙醇的叙述中,正确的是
A.都难溶于水 B.都能发生加成反应
C.都能发生氧化反应 D.都是化石燃料
难度: 简单查看答案及解析
-
元素周期表的第四周期为长周期,该周期中的副族元素共有
A.32种 B.18种 C.10种 D.7种
难度: 简单查看答案及解析
-
下列自然、生活中的事例不属于氧化还原反应的是
A.空气被二氧化硫污染后形成酸雨 B.植物进行光合作用
C.用漂粉精杀菌 D.明矾净水
难度: 简单查看答案及解析
-
pH=a 的某电解质溶液,用惰性电极电解,电解过程中溶液pH<a的是
A.NaCl B.CuSO4 C.Na2SO4 D.HCl
难度: 中等查看答案及解析
-
下列排列顺序中,正确的是
①热稳定性:H2O>HF>H2S ②离子半径:Cl->Na+>Mg2+>Al3+ ③酸性:H3PO4>H2SO4>HClO4 ④结合质子(H+)能力:OH—>CH3COO—>Cl—
A.①③ B.②④ C.①④ D.②③
难度: 简单查看答案及解析
-
关于Na2O和Na2O2的叙述正确的是
A.等物质的量时所含阴离子数目相同 B.颜色相同
C.所含化学键类型相同 D.化合物种类不同
难度: 简单查看答案及解析
-
下列反应中,与乙醇生成乙醛属于同一种反应类型的是
A.CH3CHO → CH3COOH B.CH2=CHCl→
C.
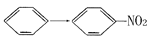 D.CH3COOH→CH3COOCH2CH3
D.CH3COOH→CH3COOCH2CH3难度: 简单查看答案及解析
-
在0.1 mol/L的Na2CO3溶液中,下列关系式正确的是( )
A.c(Na+)=2c(CO32-) B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/L D.c(HCO3-)<c(OH-)
难度: 中等查看答案及解析
-
下列与有机物的结构、性质或制取实验等有关叙述错误的是
A.苯分子结构中不含有碳碳双键,但苯也可发生加成反应
B.溴苯中溶解的溴可用四氯化碳萃取而除去
C.苯与浓硝酸和浓硫酸的混合酸反应制取硝基苯的实验最好采用水浴加热
D.乙烷和乙烯可用酸性高锰酸钾溶液加以鉴别
难度: 简单查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是

A.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性
B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小
C.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验现象相似
D.三个“封管实验”中所涉及到的化学反应不全是可逆反应
难度: 中等查看答案及解析
-
金属(M)-空气电池具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:2M+O2+2H2O=2M(OH)2。
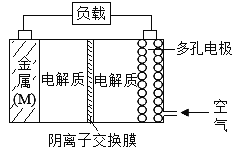
(已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能)下列说法正确的是
A.电解质中的阴离子向多孔电极移动
B.比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
C.空气电池放电过程的负极反应式2M-4e-+4OH-=2M(OH)2
D.当外电路中转移4mol电子时,多孔电极需要通入空气22.4L(标准状况)
难度: 中等查看答案及解析
-
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐(俗称钡餐)作为内服造影剂。医院抢救钡离子中毒患者时除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是
A.BaCO3的溶度积常数表达式为 Ksp(BaCO3)= n(Ba2+)·n(CO32-)
B.可用2%~5%的Na2SO4溶液给钡离子中毒患者洗胃
C.若误服含c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,X的原子中只有1个电子,Y2-和Z+ 离子的电子层结构相同,Y与W同主族。下列叙述正确的是
A.X分别与Y、Z、W形成的二元化合物中X的化合价均为+1价
B.常见氢化物的沸点:W大于Y
C.Z与W形成的化合物,其水溶液常带有臭鸡蛋气味
D.由这四种元素共同形成的两种化合物,其水溶液一种呈酸性,另一种呈碱性
难度: 中等查看答案及解析