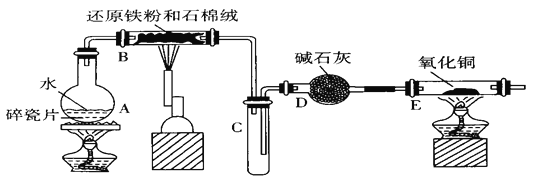
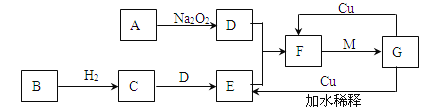
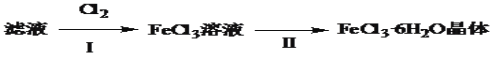-
空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A. 推广使用燃煤脱硫技术,防治SO2污染
B. 实施绿化工程,防治扬尘污染
C. 研制开发燃料电池汽车,消除机动车尾气污染
D. 加大石油、煤炭的开采速度,增加化石燃料的供应量
难度: 简单查看答案及解析
-
下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
A. 氢氧化钠与二氧化碳反应 B. 盐酸和碳酸氢钠溶液
C. 铜与硝酸反应 D. 氯化铝溶液和氢氧化钠溶液反应
难度: 中等查看答案及解析
-
Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分。铜的冶炼过程通常发生反应:Cu2S+2Cu2O=6Cu+SO2↑,下列有关说法正确的是( )
A.该反应中有三种元素的化合价发生了变化 B.每生成0.1molCu,转移0.2mol电子
C.Cu既是氧化产物又是还原产物 D.Cu2S在反应中既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
下列物质存放方法错误的是( )
A.铝片长期放置在不密封的纸盒里
B.漂白粉长期放置在烧杯中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.金属钠存放于煤油中
难度: 简单查看答案及解析
-
下列叙述正确的是
A.常温常压下,1.5 mol O2的体积约为33.6 L
B.NaOH的摩尔质量是40 g
C.100 mL水中溶解了5.85 g NaCl,则溶液中NaCl的物质的量浓度为1 mol·L-1
D.同温同压下,相同体积的任何气体所含的分子数一定相同
难度: 简单查看答案及解析
-
下列实验操作中错误的是( )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
难度: 中等查看答案及解析
-
在下列物质中,只有在溶液状态下才能导电的电解质是( )
A.NaCl B.酒精 C.H2SO4 D.CH4
难度: 简单查看答案及解析
-
下列离子方程式中正确的是( )
A.NaHCO3溶液中加入盐酸:CO32 + 2H+ == H2O + CO2↑
B.盐酸中加入碳酸钙:CO32 + 2H+ == H2O + CO2↑
C.AlCl3溶液中加入足量的氨水:Al3+ + 3OH == Al(OH)3↓
D.铜片加入三氯化铁溶液中:Cu + 2Fe3+ == 2Fe2+ + Cu2+
难度: 简单查看答案及解析
-
下列反应是氧化还原反应的是( )
A.AgNO3 + HCl ==AgCl↓+ HNO3
B.NH4HCO3
NH3↑+ CO2↑+ H2O
C.2KClO3
2KCl+3O2↑
D.CaO+H2O ==Ca(OH)2
难度: 简单查看答案及解析
-
某无色酸性溶液中,则该溶液中一定能够大量共存的离子组是( )
A.Fe2+、Ba2+、NO3-、Cl- B.Na+、NH4+、SO42-、Cl-
C.Na+、K+、SO32-、NO3- D.Na+、K+、MnO4-、Br-
难度: 中等查看答案及解析
-
下列物质都能使某些有色物质漂白或褪色,其中属于物理变化的是( )
A.H2O2 B.NaClO C.活性炭 D.Na2O2
难度: 简单查看答案及解析
-
下列反应必须加入氧化剂才能实现的是
A.KMnO4→K2MnO4 B.PCl3→PCl5 C.CO2→CO32- D.NO3-→NO
难度: 简单查看答案及解析
-
对下列物质进行的分类正确的是( )
A.纯碱、烧碱均属于碱 B.CuSO4·5H2O、液氨均属于纯净物
C.凡能电离出H+的化合物均属于酸 D.NaCl H2SO4 BaSO4 NH3 均属于电解质
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
实验操作及现象
实验结沦
A
向酸性KMnO4溶液中滴加H2O2溶液,紫色消失
H2O2具有氧化性
B
氯气通入品红溶液中,溶液褪色
氯气具有漂白性
C
将NaOH浓溶液滴加到饱和FeC13溶液中呈红褐色
制Fe(OH)3胶体
D
向某溶液加入NaOH 并微热,产生能够使湿润的红色,石蕊试纸变蓝的无色气体
该溶液中一定含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是( )
A.分离碘和酒精

B.除去Cl2中的HCl
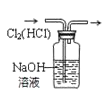
C.实验室制氨气
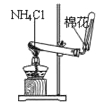
D.排水法收集NO
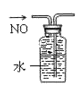
难度: 简单查看答案及解析
-
120 mL浓度为1 mol·L-1的Na2SO3溶液,恰好与100 mL浓度为0.4 mol·L-1的K2Cr2O7溶液完全反应,在还原产物中Cr元素的化合价
A.+3 B.+1 C.+4 D.+2
难度: 中等查看答案及解析