-
按下列实验方法操作,能达到要求的是( )
A. 用托盘天平称量25.20g氯化钠固体
B. 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生
C. 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体
D. 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
难度: 简单查看答案及解析
-
进行化学实验必须注意安全,下列说法不正确的是( )
A. 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
B. 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
C. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
D. 实验室中酒精燃烧,小面积着火,立即用水扑灭
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A、摩尔是用来描述微观粒子的物理量
B、1 mol任何物质都含有NA个原子
C、0.5 mol H2O中含有的原子数目为1.5NA
D、64g氧相当于2mol氧
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
难度: 中等查看答案及解析
-
分类是化学研究中常用的方法。下列分类方法中,不正确的是( )
A. 依据分子组成中含有氢
原子的数目,将酸分为一元酸、二元酸等
B. 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C. 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液
D. 依据组成元素的种类,将纯净物分为单质和化合物
难度: 中等查看答案及解析
-
盐是一种常见的物质,下列物质通过一步反应可直接形成盐的是( )
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥
C.②⑤⑥ D.全部
难度: 中等查看答案及解析
-
海带中碘元素的检验可经过以下几个步骤完成(已知H2O2能将海带中的I﹣氧化成I2,I2遇淀粉变蓝),各步骤中选用的实验用品不能都用到的是( )
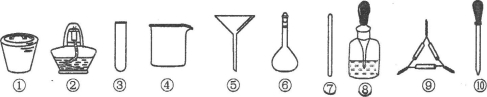
A.将海带剪碎后灼烧成灰,选用①、②和⑨
B.将海带灰加蒸馏水溶解,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.取滤液,先加入几滴稀硫酸,再滴加H2O2,最后滴加淀粉溶液,选用③和⑩
难度: 中等查看答案及解析
-
己知金属钾投入水中会发生剧烈反应,并有氢气生成。运输金属钾的包装箱应贴有的图标是( )
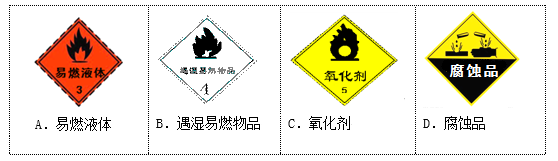
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.25℃、101KPa时,16g O2和O3混合气体中含有的原子数为NA
B.1 mol NH3中含有的质子数为17NA
C.11.2 L O2和N2的混合气体含有的分子数为0.5NA
D.金属铁与稀盐酸反应当产生0.1 mol H2时转移电子数为0.3NA
难度: 中等查看答案及解析
-
、完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl﹣,消耗等物质的量的AgNO3,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为( )
A.1:2:3 B.3:2:1 C.9:3:1 D.6:3:2
难度: 中等查看答案及解析
-
朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾所形成的种种美景的本质原因是( )
A.空气中的小水滴颗粒大小约为10﹣9m~10﹣7m
B.光是一种胶体
C.雾是一种胶体
D.发生丁达尔效应
难度: 中等查看答案及解析
-
一定量某营养液中溶质的配方分别如下:
配方一:0.3 mol KCl,0.2 mol K2SO4,0.1 mol ZnSO4
配方二:0.1 mol KCl,0.3 mol K2SO4,0.1 mol ZnCl2
对于两种营养液的成分,下列说法中正确的是 ( )
A.只有n (K+)相同 B.只有n (Cl-)相同
C.完全相同 D.各离子的物质的量完全不同
难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
B.用小苏打治疗胃酸过多:HCO3- +H+=CO2↑+H2O
C.锌片插入硝酸银溶液中:Zn+Ag+ = Zn2++Ag
D.硫酸溶液与氢氧化铜反应:H++OH-=H2O
难度: 中等查看答案及解析
-
下列离子能大量共存的是
A.无色酚酞试液呈红色的溶液中:Na+ 、K+、SO42-、CO32-
B.无色透明的溶液中:Cu2+、K+、SO42-、NO
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl-
D.紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO
难度: 中等查看答案及解析
-
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
A.盐酸中逐滴加入氢氧化钠溶液
B.硫酸铜溶液中逐滴加入氢氧化钡溶液
C.硫酸中逐滴加入氯化钡溶液
D.盐酸中逐滴加入硝酸银溶液
难度: 困难查看答案及解析
-
下列有关氧化还原反应的叙述正确的是( )
A.化合反应和复分解反应不可能是氧化还原反应
B.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C.含有最高价元素的化合物不一定具有强的氧化性
D.在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
难度: 中等查看答案及解析
-
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型有( )
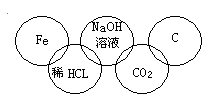
A.复分解反应
B.分解反应
C.化合反应
D.置换反应
难度: 中等查看答案及解析
-
2016年第31届奥运会在巴西里约举行。奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P =3P2O5+5KC1。下列有关该反应的叙述中,正确的是( )
A.氯酸钾是还原剂
B.KCl既是氧化产物,又是还原产物
C.反应中消耗3 mol P时,转移电子的物质的量为15 mol
D.发令时产生的白烟只是KCl固体颗粒
难度: 困难查看答案及解析
-
已知I-、Fe3+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为:
SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2
++SO
+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.2Fe2++I2===2Fe3++2I-
D.H2O2+SO2===H2SO4
难度: 困难查看答案及解析
-
已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气。测得产物中NO2与O2的体积比为5∶1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是( )
A.升高 B.降低 C.不变 D.不能确定
难度: 困难查看答案及解析
-
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
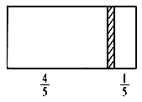
A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
难度: 中等查看答案及解析
-
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是( )
A.肯定有KNO3和Na2CO3,没有Ba(NO3)2
B.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C.肯定没有Na2CO3和Ba(NO3)2,可
能有KNO3
D.以上判断都不正确
难度: 困难查看答案及解析
