-
室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.在氯化铁溶液滴加NaOH溶液可制得氢氧化铁胶体,氢氧化铁胶体具有吸附性,常用于净水
B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子
C.“火树银花”中的焰火实质上是金属元素的焰色反应,焰色反应是复杂的化学反应
D.“晴空万里、蓝天白云”,减少化石燃料的燃烧可以减少雾霾天气
难度: 简单查看答案及解析
-
中国传统文化博大精深,源远流长,下列叙述错误的是( )
A.“梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同
B.《本草纲目拾遗》写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”“强水”是指盐酸
C.“熬胆矾铁釜,久之变化为铜”,该过程发生了置换反应
D.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.200g63%的浓硝酸中含氧原子个数为6NA
B.14g乙烯和环丙烷混合物含有的氢原子数目为2NA
C.46gNa与一定量O2完全反应生成Na2O和Na2O2,转移电子数为3NA
D.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
难度: 中等查看答案及解析
-
水杨酸、冬青油、阿司匹林的结构简式如下,下列说法不正确的是
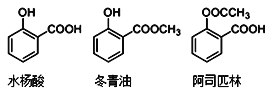
A.由水杨酸制冬青油的反应是取代反应
B.冬青油苯环上的一氯取代物有4种
C.可用FeCl3溶液检验阿司匹林中是否混有水杨酸
D.相同物质的量的冬青油和阿司匹林消耗NaOH的物质的量相同
难度: 中等查看答案及解析
-
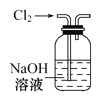
下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.除去Cl2中含有的少量HCl
B.蒸干FeCl3饱和溶液制备FeCl3晶体
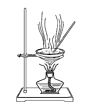
C.制取少量纯净的CO2气体
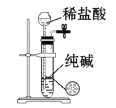
D.分离CCl4萃取碘水后已分层的有机层和水层
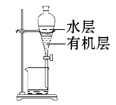
难度: 中等查看答案及解析
-
X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高价与最低价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
A.X与Y形成的化合物只有一种
B.原子半径:r(Z)<r(R)
C.R的氢化物的热稳定性比W的强
D.Y的最高价氧化物的水化物的酸性比W的强
难度: 中等查看答案及解析
-
下列解释实验过程或事实的反应方程式不正确的是
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH
Na2SiO3+H2O
B.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g)
Fe3O4+4H2
D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O
难度: 中等查看答案及解析
-
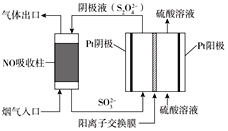
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2 +11O2
4B2O3 +2V2O5 。用该电池为电源,选用惰性电极电解一定量的硫酸铜溶液,实验装置如图所示。当电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标况),则下列说法中正确的是
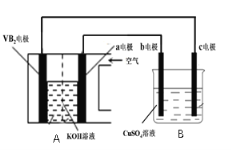
A.VB2电极发生的电极反应为: 2VB2+11H2O – 22e−
V2O5+2B2O3+22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D.若B装置内的液体体积为200mL,则CuSO4溶液的浓度为0.05mol/L
难度: 中等查看答案及解析
-
下列物质在给定条件下的同分异构体数目正确的是( )
A.C4H10属于烷烃的同分异构体有3种
B.分子组成是C5H10O2属于羧酸的同分异构体有5种
C.分子组成是C4H8O属于醛的同分异构体有3种
D.
的一溴代物有5种
难度: 困难查看答案及解析
-
常温下,下列各溶液的叙述中正确的是
A.NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(CH3COOH) >c(Cl-)>c(H+)
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D.向1.00 L 0.3 mol/LNaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
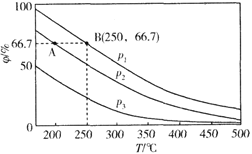
改变0.1
二元弱酸
溶液的pH,溶液中的
、
、
的物质的量分数
随pH的变化如图所示[已知
]。
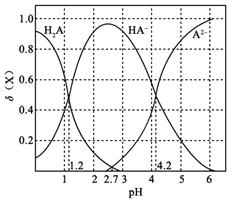
下列叙述错误的是
A. pH=1.2时,
B.
C. pH=2.7时,
D. pH=4.2时,
难度: 困难查看答案及解析
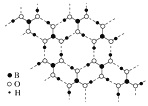

 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( )制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。