-
《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之牢盆……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘……火燃釜底,滚沸延及成盐。”文中涉及的操作是( )
A.萃取 B.结晶
C.蒸馏 D.过滤
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
难度: 中等查看答案及解析
-
下列关于有机物1-氧杂-2,4-环戊二烯(
)的说法正确的是( )
A.与
互为同系物
B.二氯代物有3种(不考虑立体异构)
C.所有原子都处于同一平面内
D.1 mol该有机物完全燃烧消耗5mol O2
难度: 简单查看答案及解析
-
NH4NO3溶液受热可发生分解反应:NH4NO3
N2↑+HNO3+H2O(未配平)。用NA表示阿伏加德罗数的值,下列说法正确的是( )
A.分解时每生成2.24 L(标准状况)N2,转移电子的数目为0.6NA
B.2.8 g N2中含有共用电子对的数目为0.3NA
C.56 g Fe与足量热浓硝酸反应生成NO2分子的数目为3NA
D.0.1 mol·L-1 NH4NO3溶液中,NH4+的数目小于0.1NA
难度: 中等查看答案及解析
-
X、Y、Z、Q、R均为短周期元素,且Y、Z、Q、R在周期表中的位置关系如下图所示。已知X与Y同主族,X与Q能形成最简单的有机物。则下列有关说法正确的是( )
Q
R
Y
Z
A. 原子半径:r(Z)>r(Y)>(R)>r(Q)
B. 气态化合物的稳定性:QX4>RX3
C. X与Y形成的化合物中含有离子键
D. 最高价含氧酸的酸性:X2QO3>XRO3
难度: 简单查看答案及解析
-
氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )

A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
难度: 简单查看答案及解析
-
甲、乙两个恒容密闭容器中均发生反应:C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH>0,有关实验数据如下表所示:
容器
容积/L
温度/℃
起始量/mol
平衡量/mol
平衡常数
C(s)
H2O(g)
H2(g)
甲
2
T1
2.0
4.0
3.2
K1
乙
1
T2
1.0
2.0
1.2
K2
下列说法正确的是( )
A.K1=12.8
B.T1<T2
C.T1 ℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大
D.若T2温度下,向2 L恒容密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率大于40%
难度: 中等查看答案及解析

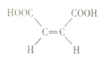 )和反丁烯二酸(
)和反丁烯二酸( )两种结构,以顺丁烯二酸为原料合成环酮的中间体F的合成路线如下:
)两种结构,以顺丁烯二酸为原料合成环酮的中间体F的合成路线如下:
 的合成路线(其他试剂任选) ________
的合成路线(其他试剂任选) ________